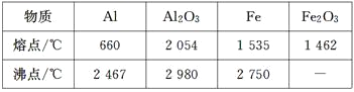
题目内容
【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D
【答案】D
【解析】
A.加入AgNO3溶液,有白色沉淀生成,可能有Ag2CO3等沉淀生成,检验氯离子时应加入稀硝酸酸化,排除杂质离子的干扰,A错误;
B.向某溶液中加入稀盐酸,有无色气体产生,气体可能为二氧化碳或二氧化硫,溶液中的离子可能含有CO32-、HCO3-、SO32-、HSO3-等,B错误;
C.向某溶液中加入BaCl2溶液,有白色沉淀生成,可能生成AgCl沉淀,也可能是BaSO4沉淀等,如检验硫酸根离子,应先加入盐酸,无现象,排除Ag+的干扰,再加入氯化钡检验,有白色沉淀产生,C错误;
D.向某溶液中加入酚酞溶液,溶液变为红色,说明溶液显碱性,则溶液中一定含有氢氧根离子,D正确;
答案选D。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目