题目内容
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________。
【答案】①② ③④ ⑥ ![]()
![]()
![]()
【解析】
根据过程中发生变化的特点以及是否有新物质生成、是否形成新化学键判断;根据物质中含有的化学键书写相应的电子式。
(1)①碘升华时,碘由固态转化为气态,只是物质状态发生变化,化学键不被破坏;
②氧气溶于水时,氧气分子存在于水中,化学键不被破坏;
③氯化钠溶于水时,氯化钠在水分子的作用力电离出钠离子和氯离子,离子键被破坏;
④烧碱熔化时,NaOH电离出钠离子和氢氧根离子,离子键被破坏;
⑤氯化氢溶于水,氯化氢在水分子的作用下电离出氢离子和氯离子,共价键被破坏;
⑥氯化铵受热分解生成氨气和氯化氢,离子键和共价键被破坏;
通过以上分析知,化学键没有被破坏的是①②;仅发生离子键破坏的是③④;
(2)既发生离子键又发生共价键破坏的是⑥;
(3)氮气为共价分子,氮氮原子间形成三对共用电子对,其电子式为![]() ;Na2O2为离子化合物,钠离子和过氧根离子间为离子键,其电子式为
;Na2O2为离子化合物,钠离子和过氧根离子间为离子键,其电子式为![]() ;CO2为共价化合物,碳氧原子间形成双键,其电子式为
;CO2为共价化合物,碳氧原子间形成双键,其电子式为![]() 。
。

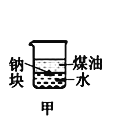
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D