题目内容
【题目】I.常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)________
(2)溶液中共有________ 种不同的微粒。
(3)这些微粒中浓度为0.01 mol·L-1的是_____,浓度为0.002 mol·L-1的是___。
(4)______和_______两种微粒的物质的量之和比OH-的物质的量多0.008 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为________。
【答案】 NH3·H2O![]() NH4++OH- NH4++ H2O
NH4++OH- NH4++ H2O![]() NH3·H2O+H+ H2O
NH3·H2O+H+ H2O![]() H+ +OH- 7 Cl- Na+ NH4+ H+ B CD 4 3
H+ +OH- 7 Cl- Na+ NH4+ H+ B CD 4 3
【解析】分析I.(1)根据铵根水解、一水合氨和水均是弱电解质解答;
(2)根据溶液中微粒的电离或水解情况判断;
(3)根据物料守恒分析;
(4)根据电荷守恒分析;
II.(5)①根据除杂时不能引入新杂质分析;
②根据除杂时不能引入新杂质分析;
(6)根据溶度积常数的概念和表达式计算。
详解:I.(1)常温下将0.01 molNH4Cl和0.002 molNaOH溶于水配成1 L溶液,溶液中存在的物质有氯化钠、一水合氨以及过量的氯化铵,其中铵根水解,一水合氨和水均是弱电解质,因此该溶液中存在的平衡体系有NH3·H2O![]() NH4++OH-、NH4++ H2O
NH4++OH-、NH4++ H2O![]() NH3·H2O+H+、H2O
NH3·H2O+H+、H2O![]() H+ +OH-;
H+ +OH-;
(2)溶液中存在的物质有氯化钠、一水合氨以及过量的氯化铵,其中铵根水解,一水合氨和水均存在电离平衡,因此溶液中共有铵根、氢离子、钠离子、氢氧根、氯离子、一水合氨、水分子等7种不同的微粒;
(3)根据氯原子守恒可知这些微粒中浓度为0.01 mol·L-1的是Cl-,根据钠原子守恒可知浓度为0.002 mol·L-1的是Na+。
(4)根据电荷守恒可知c(H+)+c(Na+)+c(NH4+)=c(Cl-)+c(OH-),则c(H+)+c(NH4+)-c(OH-)=c(Cl-)-c(Na+)=0.01mol/L-0.002mol/L=0.008mol/L,所以H+和NH4+两种微粒的物质的量之和比OH-的物质的量多0.008 mol。
II.(5)①高锰酸钾、氯水和硝酸均能氧化亚铁离子,但会引入新杂质,双氧水的还原产物是水,不能引入新杂质,答案选B;
②选项中的四种物质均能消耗氢离子调节pH,但氢氧化钠和氨水会引入新杂质钠离子和铵根离子,氧化铜和氢氧化铜反应后生成铜离子,不会引入新杂质,答案选CD;
(6)铜离子浓度是3.0mol/L,则开始沉淀时溶液中氢氧根浓度是![]() =1×10-10mol/L,则氢离子浓度是10-4mol/L,所以Cu(OH)2开始沉淀时溶液的pH为4;Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液中氢氧根浓度是
=1×10-10mol/L,则氢离子浓度是10-4mol/L,所以Cu(OH)2开始沉淀时溶液的pH为4;Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液中氢氧根浓度是![]() ,所以溶液中氢离子浓度是10-3mol/L,因此pH=3。
,所以溶液中氢离子浓度是10-3mol/L,因此pH=3。

【题目】(题文)Ⅰ.化学课上老师演示了如下图的实验:
实验时,将两气球内的NaHCO3和Na2CO3同时倒入试管中。已知盐酸是足量的,且整套装置气密性良好,回答下列问题:
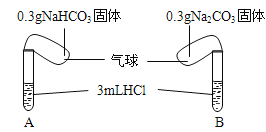
(1)实验过程中观察到的现象是:________________.
(2)实验结束后,两试管的气球大小有差异,大小气球(包含试管)体积之比约为(填最简单整数比)__________.
Ⅱ.当甲同学用手触摸上述试管时,意外发现A试管变冷,而B试管发热,他把这个发现告诉了同桌乙同学,并由此得出结论:NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.乙同学却对此结论却持怀疑的态度.为此,两位同学在课外活动中继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后温度 |
① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
(1)该研究报告的题目是《___________________________》.
(2)该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称是______________________.
(3)实验①和②的目的是_________________________________________________.
(4)通过上述实验可得出的结论是:___________________________________(写出两条即可).
【题目】某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验过程 | 实验现象 | |
实验1 |
| 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________,反应的离子方程式是____________________________________。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________。
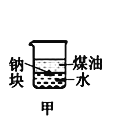
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D