题目内容
(7分)现有22g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与200mL含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐70g,求(要求写出计算过程)
(1)硫酸溶液的质量?
(2)生成的气体体积(标准状况)?
(3)硫酸物质的量浓度?
(1)m(SO42-)=m(无水盐)-m(金属)=70-22=48g 1分
n(SO42-)=48/96=0.5mol=n(H2SO4)
m(H2SO4)=0.5×98=49g 1分
m(H2SO4溶液)=49/20%=245g 1分
(2)n(H2)=n(H2SO4)=0.5mol V(H2)=0.5×22.4=11.2L 2分
(3)c(H2SO4)=0.5/0.2=2.5mol·L-1 2分
解析试题分析:金属与硫酸恰好反应生成硫酸盐与氢气,根据质量守恒可知m(SO42-)=80g-22g=48g,则n(H2SO4)=n(SO42-)=0.5mol,根据关系式H2SO4~H2↑计算氢气的体积;再根据c=n/v计算硫酸的物质的量浓度。
考点:考查与化学反应相关的计算。

(15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
(1)预处理时,将煤矸石焙烧2小时的目的是 。
(2)酸浸操作中,过量H2SO4的作用是 。
在实验室中进行该操作时,用到玻璃仪器有 、 。
(3)用NaOH溶液调节pH的最佳范围是 。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是 、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 。
(二)分析与讨论:
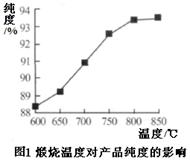
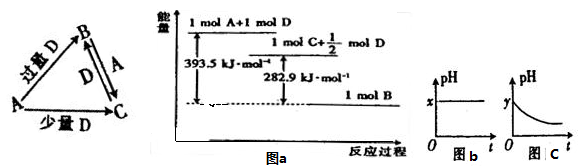
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在 ℃。
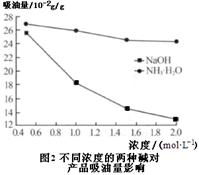
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是 。
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式: 。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 | ; |
| 步骤2:____________________________________ ____________________________________。 | |
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, 。
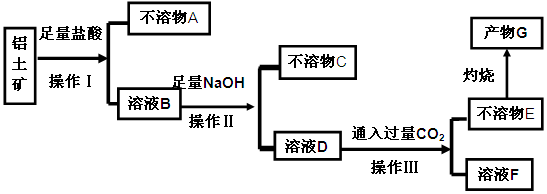
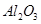 ,含
,含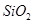 、
、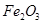 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: