题目内容
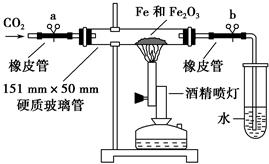
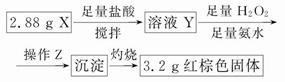
(15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
(1)预处理时,将煤矸石焙烧2小时的目的是 。
(2)酸浸操作中,过量H2SO4的作用是 。
在实验室中进行该操作时,用到玻璃仪器有 、 。
(3)用NaOH溶液调节pH的最佳范围是 。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是 、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 。
(二)分析与讨论:
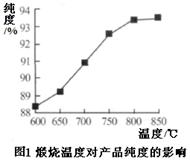
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在 ℃。
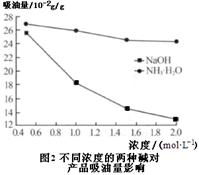
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是 。
(1)将煤矸石中的矿物转化为氧化物,便于酸浸 (2分)
(2)提高浸取率,抑制Fe3+等水解 (2分)
烧杯、玻璃棒 (各1分)
(3)2.8≤pH<3.3;(2分) 继续加碱调pH至12.2,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤 (2分)
(4)加水恰好浸没滤渣,待滤尽后重复2~3次 (2分)
(5)800 (1分)
(6)用NaOH溶液,获得的氧化铁表面积小,吸油量低(2分)
解析试题分析:(1)将煤矸石焙烧2小时,反应充分,可将煤矸石中的矿物转化为氧化物,便于酸浸。
(2)酸浸后生成Fe2(SO4)3,所以过量H2SO4可以提高浸取率,抑制Fe3+等水解。
(3)根据表中数据,Fe3+完全沉淀时的pH为2.8,而Al3+开始沉淀时的pH为3.3,要使Fe3+完全转化为沉淀而不含杂质,调节pH的最佳范围是2.8≤pH<3.3;继续加碱调pH至12.2,Mg2+完全转化为Mg(OH)2沉淀,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤,可获取较纯净的硫酸镁晶体。
(4)滤渣水洗的操作是:加水恰好浸没滤渣,待滤尽后重复2~3次。
(5)根据图1曲线,800℃时产品的纯度达到较大值,再升温,纯度升高不大,所以煅烧时温度最好控制在800℃
(6)根据图2两条曲线可知:用NaOH溶液,获得的氧化铁表面积小,吸油量低。
考点:本题考查物质的制备、基本操作、图像的分析。

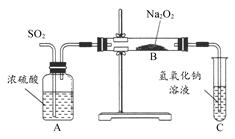
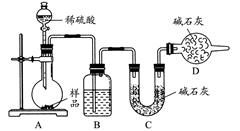
(16分)铜与浓硫酸反应,实验装置如图所示。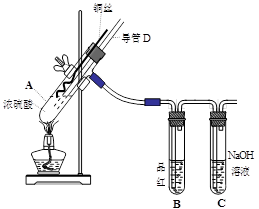
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
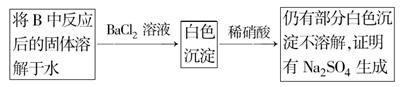
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|
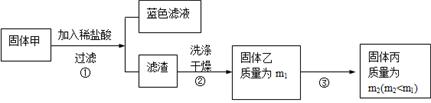 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。