题目内容
某化学兴趣小组模拟工业上从铝土矿(主要成分是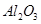 ,含
,含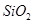 、
、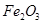 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: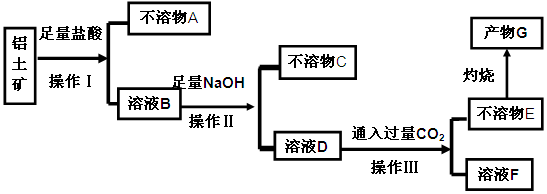
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(2)验证溶液B中是否含有Fe3+的方法: 。
(3)不溶物A是 (填化学式),写出D→E反应的离子方程式 。
(4)说出溶液F中含碳元素溶质的一种用途 。
(1)过滤(2分)
(2)取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ (2分)
(3)SiO2(2分)AlO2―+2H2O+CO2=HCO3―+Al(OH)3↓(2分)
(4)发酵粉 治疗胃酸过多等(2分)
解析试题分析:加入盐酸后,铝土矿中的Al2O3、Fe2O3、MgO能和盐酸反应,而SiO2不能溶解,即不溶物A是SiO2,操作Ⅰ是过滤;所得的滤液B有氯化铝、氯化铁、氯化镁以及过量的盐酸,向其中加过量的烧碱,所得不溶物C为Mg(OH)2 Fe(OH)3,操作Ⅱ也是过滤, 所得滤液D的主要成分为偏铝酸钠,通入过量CO2的化学方程式为NaA1O2+CO2+H2O=Al(OH)3 ↓+NaHCO3,操作Ⅲ也是过滤,将它们分离,不溶物E为Al(OH)3,灼烧后生成产物G为Al2O3,(1)操作Ⅰ、Ⅱ、Ⅲ的名称为过滤,答案:过滤。(2)验证溶液B中是否含有Fe3+的方法:取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ 。答案:取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ 。(3)不溶物A是SiO2,写出D→E反应的离子方程式:AlO2―+2H2O+CO2=HCO3―+Al(OH)3↓,答案:SiO2(2分)AlO2―+2H2O+CO2=HCO3―+Al(OH)3↓(2分);(4)NaHCO3,可以制纯碱或做发酵粉、治疗胃酸过多等,答案;发酵粉 治疗胃酸过多等。
考点:制备实验方案的设计;离子方程式的书写

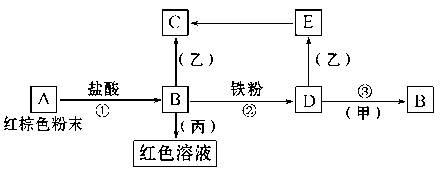
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是 。发生反应的离子方程式为 ;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为 。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂。
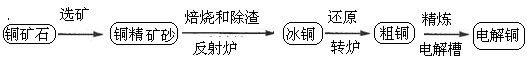
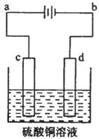
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。 4AlCl3+3O2 ↑。请回答下列问题:
4AlCl3+3O2 ↑。请回答下列问题: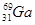 ,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。