题目内容
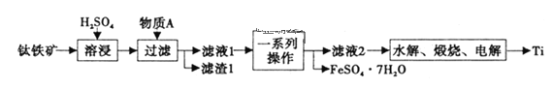
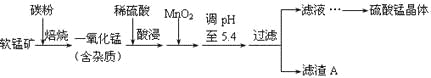
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
【答案】MnO+2H+=Mn2++H2O 确保铁元素在后续操作中完全转化为氢氧化物沉淀而除去 Al(OH)3、Fe(OH)3 Zn+2OH--2e-=Zn(OH)2 Mn2++2H2O-2e-=MnO2+4H+ 17.4 Mn(OH)2 MnCO3 MnS
【解析】
软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)加入碳粉焙烧,MnO2转化为一氧化锰,用稀硫酸浸取,一氧化锰转化为MnSO4,同时铁和铝也和稀硫酸反应进入溶液中,用MnO2氧化Fe2+成为Fe3+,便于通过调节溶液的PH使之转化为Fe(OH)3沉淀而除去。调节溶液的PH至5.4时,Fe3+和Al3+都成为氢氧化物而除去,滤液中主要含有Mn2+,用来制取硫酸锰。
(1)一氧化锰用硫酸酸浸时生成硫酸锰和水,因此发生反应的离子方程式为MnO+2H+=Mn2++H2O;根据表中数据可知,氢氧化亚铁完全沉淀时的pH值是9.7,因此在pH等于5.4的条件下不能沉淀无法除去。而氢氧化铁完全沉淀时的pH值只有3.2,所以酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+的目的是保铁元素在后续操作中完全转化为氢氧化物沉淀而除去。
(2)根据表中数据可知,在pH等于5.4的条件下铝离子与铁离子已经完全转化为氢氧化物沉淀,因此滤渣A的成分除MnO2外,还有Al(OH)3、Fe(OH)3。
(3)MnO2是制造碱性锌锰电池的基本原料,而原电池中负极失去电子,发生氧化反应,该原电池中锌是负极,则放电时负极的电极反应式为Zn+2OH--2e-=Zn(OH)2;电解池中阳极失去电子,发生氧化反应,则工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,则锰离子在阳极放电,因此阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+;电解池中阴极得到电子,发生还原反应,则阴极是溶液中的氢离子放电产生氢气。当阴极产生4.48L(标况)氢气,其物质的量是0.2mol,转移0.2mol×2=0.4mol电子,所以根据电子守恒可知,阳极生成二氧化锰的物质的量是0.2mol,则MnO2的理论产量为0.2mol×87g/mol=17.4g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,由于碳酸锰与硫化锰的组成特点相似,因此溶液中的锰离子浓度与溶度积常数成正比,即溶度积常数越大,锰离子浓度越大,所以Mn2+浓度是MnCO3>MnS。根据溶度积常数可知,碳酸锰和氢氧化锰溶液中Mn2+浓度分别为![]() 、
、![]() ,显然前者小于后者,所以上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS。
,显然前者小于后者,所以上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS。

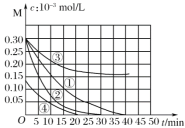
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快