题目内容
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为![]() 制备原料为
制备原料为![]() 、
、![]() 和
和![]() ,电解液为
,电解液为![]() 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______![]() 用元素符号表示
用元素符号表示![]() 。
。
(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为______,1mol碳酸丙烯酯中σ键的数目为______。

![]() 的几何构型为正八面体形,配体是______,该配离子包含的作用力为______
的几何构型为正八面体形,配体是______,该配离子包含的作用力为______![]() 填选项字母
填选项字母![]() 。
。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
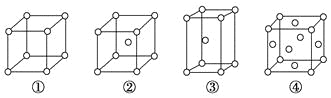
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则Na与O之间的最短距离为_______________________
,则Na与O之间的最短距离为_______________________ ![]() 用含ρ、
用含ρ、![]() 的代数式表示
的代数式表示![]() 。
。

【答案】p 5s25p4 6 O>Cl>C sp2 、sp3 13NA(或13×6.02×1023) H2O BC 
【解析】
(1)根据最后填入电子的轨道名称确定所属区域;s区的元素为第IA、IIA族元素;第IB、IIB族为ds区,镧系元素、锕系元素为f区,ⅢB~ⅦB族(镧系元素、锕系元素产物)、第Ⅷ族为d区元素,ⅢA~ⅦA族、零族为p区;
(2)原子的电子总数等于原子序数,根据构造原理可知其电子排布式,据此可判断该基态原子中电子占据的原子轨道总数;
(3)元素的非金属性越强其电负性越大;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式,单键为sp3杂化,双键为sp2杂化,叁键为sp杂化;
(5)[Co(H2O)6]3+中,1个Co原子结合6个配位体,说明提供6个空轨道,该配位离子的形成是共价键;
(6)根据图知,O离子配位数是8;根据密度公式ρ=![]() 计算晶胞中距离最近的Na与O之间的距离。
计算晶胞中距离最近的Na与O之间的距离。
(1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,Te原子为52号元素,位于周期表第五周期、第VIA族,外围电子排布式为5s25p4,属于p区,故答案为:p;5s25p4;
(2)Na元素的原子序数为11,基态原子的电子排布式为:1s22s22p63s1,每个能级字母前的数字表示电子层数,所以该元素含有3个电子层,根据电子云的空间形状可知,各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,该元素含有s、p能级,6个轨道,故答案为:6;
(3)元素的非金属性越强其电负性越大,O、Cl、C的非金属性大小顺序是O>Cl>C,所以其电负性大小顺序是O>Cl>C,故答案为:O>Cl>C;
(4)碳酸丙烯酯中碳原子为单键和双键,单键形成4个σ键,没有孤对电子,杂化轨道数目为4,为sp3杂化,双键形成3个σ键,没有孤对电子,杂化轨道数目为3,sp2杂化,所以碳原子的杂化轨道类型为sp2、sp3,σ键的总数目为13,即l3NA(或13×6.02×1023),故答案为:sp2、sp3;l3NA(或13×6.02×1023);
(5)配合物中中心原子提供空轨道,配体提供孤电子对。[Co(H2O)6]3+的几何构型为正八面体形,Co3+在中心提供空轨道,配体是H2O提供孤电子对,1个Co提供6个空轨道。离子中存在配位键,该配位离子H-O的作用力为极性共价键,故答案为:H2O;BC;
(6)白色球为O原子,晶胞中白色球数目为8×1/8+6×1/2=4,黑色球为Na原子,而原子配位数与原子数目成反比,故O原子配位数为4×2=8,Na原子周围距离最近的4个O原子形成正四面体,顶点O原子与正四面体体心的O原子连线处于晶胞体对角线上,晶胞体积V=![]() cm3,晶胞边长=
cm3,晶胞边长= cm,则Na与O之间的最短距离为
cm,则Na与O之间的最短距离为 cm,故答案为:8;
cm,故答案为:8; 。
。

【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)M在元素周期表中的位置为________________。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________;所含化学键类型_________。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________。
Ⅱ.如下图转化关系:![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________。
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。