题目内容
【题目】在体积恒定的密闭容器中,1 mol A(g)与1 mol B(g)在催化剂作用下加热到500 ℃发生反应:A(g)+nB(g)![]() C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
A.升高温度v(正)增大,v(逆)减小,平衡向正反应方向移动
B.平衡后再加入1 mol B,上述反应的ΔH增大
C.当n<1时,通入惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
【答案】D
【解析】
A.升高温度,化学反应速率加快,v(正)增大,v(逆)也增大,化学平衡向吸热的正反应方向移动,A错误;
B.增加反应物B的量,反应物浓度增大,会使化学平衡正向移动,但是该反应的△H不变,B错误;
C.通入惰性气体,由于反应容器的容积不变,各组分的浓度不变,化学平衡不移动,C错误;
D.对于反应A(g)+nB(g)![]() C(g)+D(g) ΔH>0 假设反应容器的溶解为1 L,则反应开始时c(A)=c(B)=1 mol/L,c(C)=c(D)=0,由于A的转化率为50%,则平衡时c(A)=c(B)=(1 -0.5)mol/L=0.5 mol/L,c(C)=c(D)=0.5 mol/L,所以化学平衡常数K=
C(g)+D(g) ΔH>0 假设反应容器的溶解为1 L,则反应开始时c(A)=c(B)=1 mol/L,c(C)=c(D)=0,由于A的转化率为50%,则平衡时c(A)=c(B)=(1 -0.5)mol/L=0.5 mol/L,c(C)=c(D)=0.5 mol/L,所以化学平衡常数K=![]() =
=![]() =1,D正确;
=1,D正确;
故合理选项是D。

 字词句段篇系列答案
字词句段篇系列答案【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
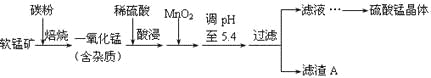
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。