题目内容
【题目】现将0.04mol·L-1的某酸(A)溶液和0.02mol·L-1NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是___;若A为HCl,100℃时(Kw=10-12),溶液中由水电离出的H+浓度为___mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力___水解能力(填“>”“<”“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
(3)用浓度为0.01mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为amL、bmL、cmL,则a、b、c的大小关系是___。
【答案】c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 10-10 < ③>②>① a>b>c
【解析】
0.04mol·L-1的某酸(A)溶液和0.02mol·L-1NaOH溶液等体积混合,所得溶液Q为0.01mol·L-1的某酸(A)与0.01mol·L-1的某酸钠盐的混合溶液。若混合溶液显酸性,则主要发生某酸的电离;若混合溶液呈碱性,则主要发生某酸钠盐的水解,若混合溶液呈中性,则可认为某酸的电离程度与某酸盐的水解程度相等。
(1)若A为CH3COOH,所得溶液为0.01mol·L-1CH3COOH与0.01mol·L-1CH3COONa的混合溶液,Q呈酸性,则CH3COOH电离大于CH3COO-的水解,溶液中所有离子按浓度由大到小排列的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-);若A为HCl,则所得溶液为0.01mol·L-1HCl与0.01mol·L-1NaCl的混合溶液,c(H+)=0.01mol·L-1,100℃时(Kw=10-12),溶液中由水电离出的H+浓度为![]() mol·L-1=10-10mol·L-1;若A为H2S,则所得溶液为0.01mol·L-1H2S与0.01mol·L-1NaHS的混合溶液,Q接近中性,则表明HS-易发生水解,即HS-电离能力<水解能力。答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);10-10;<;
mol·L-1=10-10mol·L-1;若A为H2S,则所得溶液为0.01mol·L-1H2S与0.01mol·L-1NaHS的混合溶液,Q接近中性,则表明HS-易发生水解,即HS-电离能力<水解能力。答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);10-10;<;
(2)①NaHS中,NaHS=Na++HS-、HS-+H2O![]() H2S+OH-、HS-
H2S+OH-、HS-![]() H++S2-、H2O
H++S2-、H2O![]() H++OH-,阴离子总浓度= c(S2-)+c(OH-)+c(HS-)=0.1mol/L+ c(OH-)(最后一步水电离);
H++OH-,阴离子总浓度= c(S2-)+c(OH-)+c(HS-)=0.1mol/L+ c(OH-)(最后一步水电离);
②CH3COONa中,CH3COONa=CH3COO-+Na+、CH3COO-+H2O![]() CH3COOH+OH-、H2O
CH3COOH+OH-、H2O![]() H++OH-,阴离子总浓度= c(CH3COO-)+c(OH-)=0.1mol/L+ c(OH-)(最后一步水电离);
H++OH-,阴离子总浓度= c(CH3COO-)+c(OH-)=0.1mol/L+ c(OH-)(最后一步水电离);
③NaCl溶液中,NaCl=Na++Cl-、H2O![]() H++OH-,阴离子总浓度= c(Cl-)+c(OH-)=0.1mol/L+ c(OH-)(最后一步水电离);
H++OH-,阴离子总浓度= c(Cl-)+c(OH-)=0.1mol/L+ c(OH-)(最后一步水电离);
对于①、②来说,最后一步水电离,都受到前面生成OH-的抑制,且①中抑制作用最强,②中次之,③中不受影响,所以阴离子总浓度由大到小的顺序为③>②>①。答案为:③>②>①;
(3)浓度为0.01mol·L-1的溶液的酸性:HCl溶液>CH3COOH溶液>H2S溶液,弱酸溶液中,要使滴定后的混合溶液呈中性,弱酸必须有剩余,所以酸性越弱,酸剩余越多,消耗NaOH的体积越小,故a、b、c的大小关系是a>b>c。答案为:a>b>c。

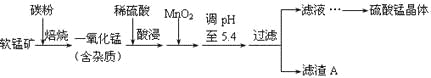
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。