题目内容
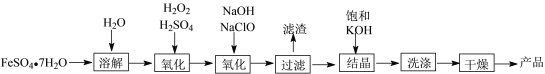
【题目】碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下。

(1)“氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程式_____________。
(2)“吹出”在吹出塔中进行,含碘卤水从_______(填“塔顶”或“塔底”)进入, 请解释这样做的原因_______________________
(3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_______;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO![]() 进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO
进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO![]() 的物质的量之比为_______。
的物质的量之比为_______。
(4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO![]() ,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2______g。
,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2______g。
【答案】5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl 塔顶 因热空气密度小,且气体与溶液逆向接触,有利于提高吹出率 萃取(或萃取 分液) 5∶1 170
【解析】
卤水中碘和过量的氯气发生氧化还原反应生成HCl和HIO3,反应物的接触时间越长,反应越充分,所以含碘卤水应该从塔顶加入,热空气从塔底吹入,向剩余液体中加入二氧化硫和水,发生氧化还原反应生成HI和硫酸,再向溶液中通入氯气,氯气将HI氧化生成碘单质,最后通过精制得到碘单质,据此分析解答。
(1)过量的氯气、碘在水溶液中发生氧化还原反应生成碘酸和HCl,反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(2)反应物接触时间越长,反应越充分,热空气密度小,且气体与溶液逆向接触,有利于提高吹出率,所以含碘卤水从塔顶进入,热空气从塔底进入,故答案为:塔顶;因热空气密度小,且气体与溶液逆向接触,有利于提高吹出率;
(3)碘在四氯化碳中的溶解度远远大于在水中的溶解度且碘和四氯化碳不反应,四氯化碳和水不互溶,所以可以采用萃取分液法分离;NaOH溶液与I2反应,生成的I-、IO![]() 进入水溶液,离子反应方程式为6OH-+3I2=5I-+IO
进入水溶液,离子反应方程式为6OH-+3I2=5I-+IO![]() +3H2O,根据方程式知,加入NaOH后溶液中I-、IO
+3H2O,根据方程式知,加入NaOH后溶液中I-、IO![]() 的物质的量之比为5∶1,故答案为:萃取分液;5∶1;
的物质的量之比为5∶1,故答案为:萃取分液;5∶1;
(4)1m3的254mg/L的卤水中n(I-)=![]() =2mol,H2O2将卤水中的I-氧化为IO
=2mol,H2O2将卤水中的I-氧化为IO![]() ,发生的反应为3H2O2+I-=3H2O+IO
,发生的反应为3H2O2+I-=3H2O+IO![]() ①,酸性条件下,I-和碘酸根离子反应方程式为5I-+IO
①,酸性条件下,I-和碘酸根离子反应方程式为5I-+IO![]() +6H+=3I2+3H2O②,根据方程式②知参加反应的I-和IO
+6H+=3I2+3H2O②,根据方程式②知参加反应的I-和IO![]() 的关系是5∶1,根据I原子守恒得发生反应①消耗I-与生成IO
的关系是5∶1,根据I原子守恒得发生反应①消耗I-与生成IO![]() 关系为1∶1,所以反应①中消耗I-的物质的量占总物质的量的
关系为1∶1,所以反应①中消耗I-的物质的量占总物质的量的![]() =2mol×
=2mol×![]() =
=![]() mol,则消耗n(H2O2)=3×
mol,则消耗n(H2O2)=3×![]() mol=1mol,理论上需20%的H2O2=
mol=1mol,理论上需20%的H2O2=![]() =170g,故答案为:170。
=170g,故答案为:170。

【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
|
| ||||
相对分子质量 | 密度/(g/cm-3) | 沸点/℃ | 水中溶解性 | ||
异戊醇 | 88 | 0.8123 | 131 | 微溶 | |
乙酸 | 60 | 1.0492 | 118 | 溶 | |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 | |
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器B的名称是__。
(2)在洗涤操作中,第一次水洗的主要目的是__;第二次水洗的主要目的是__。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__。
(5)在蒸馏操作中,仪器试剂的选择及安装都正确的是__(填标号)。
A.  B.
B.
C. D.
D.
(6)本实验的产率是__。
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”),其原因是__。