题目内容
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
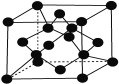
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)
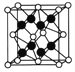
(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
【答案】平面正三角形 sp3 低 BN 白磷是非极性分子,水是极性分子,CS2是非极性分子,相似相溶 Cu+可与氨形成易溶于水的配位化合物(或配离子) [Cu(NH3)4]2+ ![]() 金属键 Cu3AuH8
金属键 Cu3AuH8
【解析】
(1)BF3中B原子形成3个B-F键,没有孤电子对,价层电子对数3+0=3,空间构型为平面正三角形;SO32-中心原子S原子孤电子对数=![]() =1,杂化轨道数目=3+1=4,S原子采取sp3杂化;
=1,杂化轨道数目=3+1=4,S原子采取sp3杂化;
(2)H2O2分子之间形成氢键,而H2S分子之间不能形成氢键,常温下前者为液体,后者为气体,故H2S的沸点比H2O2的沸点低;均属于原子晶体,原子半径B<Al<Ga,共价键键长:N-B<N-Al<N-Ga,故键能N-B>N-Al>N-Ga,因此BN的熔点最高;
(3)白磷是非极性分子,水是极性分子,CS2是非极性分子,相似相溶,因此白磷不溶于水,易溶于CS2;
(4)Cu+可与氨形成易溶于水的配位化合物(或配离子),所以该化合物易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为[Cu(NH3)4]2+;
(5)晶胞中黑色球数目为8,白色球数目=8×![]() +6×
+6×![]() =4,故黑色球为F,白色球为Ca,晶胞质量=
=4,故黑色球为F,白色球为Ca,晶胞质量=![]() g,晶胞体积=
g,晶胞体积=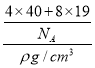 cm3,则晶胞的边长=
cm3,则晶胞的边长=![]() cm;
cm;
(6)该合金晶体中原子之间的作用力为金属键;该晶胞中Au原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,CaF2晶胞中含有4个Ca2+和8个F-,氢原子相当于晶胞中的F离子,则晶胞中Cu、Au原子总数与H原子数目之比为1:2,所以该晶胞中应含有8个H,该晶体储氢后的化学式为Cu3AuH8。
=3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,CaF2晶胞中含有4个Ca2+和8个F-,氢原子相当于晶胞中的F离子,则晶胞中Cu、Au原子总数与H原子数目之比为1:2,所以该晶胞中应含有8个H,该晶体储氢后的化学式为Cu3AuH8。

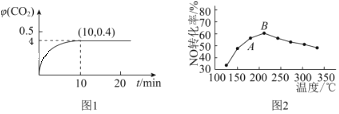
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%