题目内容
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 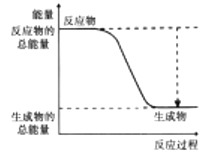 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。
【答案】ABC A
化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
1molO2中的化学键 | |||
形成化学键 | 4molH-O键 | 放出热量 | 1852 |
总能量变化 | 放出热量 | 484 | |
负 氧化
【解析】
(1)为了加快![]() 的正反应速率:
的正反应速率:
A.使用催化剂,可以加快化学反应速率;
B.适当提高氧气的浓度,可以加快;
C.适当提高反应的温度,可以加快化学反应速率;
故可以采取的措施有ABC。
(2)该反应为放热反应,反应物的总能量高于生成物的总能量,故能正确表示该反应中能量变化的是A。
(3)H—H的键能为436 kJ·mol-1,O=O的键能496 kJ·mol-1,故破坏2molH2和1molO2的化学键共需吸收的热量为436kJ2+496 kJ= 1368 kJ;
H—O的键能为463 kJ·mol-1,故形成4molH-O键放出的热量为463 kJ4=1852kJ;
反应中的能量变化为放出热量1852kJ-1368 kJ=484kJ。
填表如下:
化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
1molO2中的化学键 | |||
形成化学键 | 4molH-O键 | 放出热量 | 1852 |
总能量变化 | 放出热量 | 484 | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气是还原剂,其在负极发生氧化反应。
。其中,氢气是还原剂,其在负极发生氧化反应。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是____________________。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 预期现象和结论 |
实验Ⅱ | 将实验Ⅰ中收集的气体点燃 | ______________________________________ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | 如果出现______________,则白色不溶物可能是MgCO3 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在______离子 |
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________________________。

(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡的原因__________。





