题目内容
17.能正确表示下列反应的离子方程式是( )| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
分析 A.硝酸具有强氧化性,能够将亚铁离子氧化成铁离子,同时生成NO气体;
B.氢氧化钡质量,铵根离子和碳酸氢根离子完全反应,漏掉了铵根离子与氢氧根离子的反应;
C.二氧化碳过量,反应生成碳酸氢钙;
D.硫酸铝铵与氢氧化钡按照物质的量1:3反应,氢氧化钡过量,反应生成一水合氨、偏铝酸钠和硫酸钡沉淀.
解答 解:A.Fe3O4与过量的稀HNO3反应,生成的亚铁离子被稀硝酸氧化成了铁离子,反应的离子方程式为:3Fe3O4+28H++NO3-=NO↑+9Fe3++14H2O,故A错误;
B.NH4HCO3溶液与足量Ba(OH)2溶液混合,铵根离子和碳酸氢根离子都完全反应,正确的离子方程式为:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O,故B错误;
C.向澄清石灰水中通入过量CO2,反应生成碳酸氢钙,反应的离子方程式为:OH-+CO2═HCO3-,故C正确;
D.将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合,硫酸铝铵与氢氧化钡按照物质的量1:3反应,氢氧化钡过量,正确的离子方程式为:2Ba2++NH4++Al3++2SO42-+5OH-═AlO2-+2BaSO4↓+NH3•H2O+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
8.已知25℃、101kPa下,下列反应
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |
2.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的( )
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 氯水可以导电(Cl2) | |
| C. | 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
9.请根据下面信息,判断下列叙述中正确的是( )

| A. | 1mol H2O 分解为H2与O2需吸收930 kJ热量 | |
| B. | H与O反应生成1mol H2O放出930 kJ热量 | |
| C. | 2 mol H的能量小于1mol H2的能量 | |
| D. | H结合成H2放出436 kJ的热量 |
6.下列物质具有固定熔沸点的是( )
| A. | 钢化玻璃 | B. | 漂白粉 | C. | 消石灰 | D. | 水玻璃 |
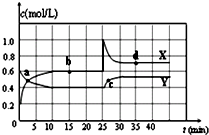 在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.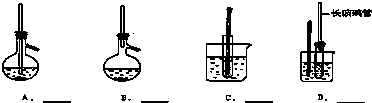
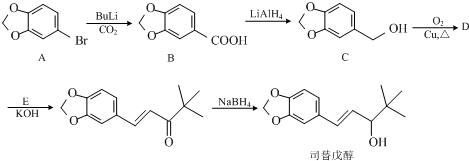
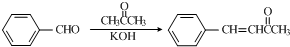
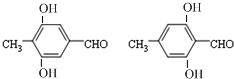 (任意一种);.
(任意一种);.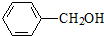 为原料制备
为原料制备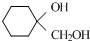 的反应合成路线流程图(无机试剂任用).
的反应合成路线流程图(无机试剂任用).