题目内容
5.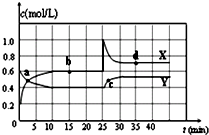 在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.(1)该反应的化学方程式为 (反应物或生成物用符号X、Y表示):Y?2X.
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
分析 (1)根据图知,从开始到达到平衡状态,X的物质的量浓度增大、Y的物质的量浓度减小,所以Y是反应物、X是生成物;
0-10min内,△c(Y)=(0.6-0.4)mol/L=0.2mol/L,△c(X)=(0.6-0.2)mol/L=0.4mol/L,同一可逆反应同一时间段内各物质的浓度变化量之比等于其计量数之比,据此确定化学方程式;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变.
解答 解:(1)根据图知,从开始到达到平衡状态,X的物质的量浓度增大、Y的物质的量浓度减小,所以Y是反应物、X是生成物;
0-10min内,△c(Y)=(0.6-0.4)mol/L=0.2mol/L,△c(X)=(0.6-0.2)mol/L=0.4mol/L,同一可逆反应同一时间段内各物质的浓度变化量之比等于其计量数之比,所以Y、X的计量数之比=0.2mol/L:0.4mol/L=1:2,则该反应方程式为Y?2X,故答案为:Y?2X;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变,根据图知,bd段各物质的物质的量浓度不变,说明该反应达到平衡状态,故答案为:bd.
点评 本题考查图象分析,涉及化学平衡状态的判断、化学方程式的确定等知识点,把握物质的量浓度变化量与计量数的关系及平衡状态的判断方法即可解答,题目难度不大.

练习册系列答案
相关题目
16.下列事实能说明某物质是强电解质的是( )
| A. | 该物质在水中的溶解度大 | |
| B. | 该物质的水溶液导电能力强 | |
| C. | 该物质的水溶液中不存在溶质分子 | |
| D. | 该物质的水溶液中不存在除水外的电离平衡 |
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | CH3CH(CH2CH3)CH2CH3 2-乙基丁烷 | B. | CH2CHBr2 二氯乙烷 | ||
| C. | CH3CH(CH3)CH=CH2 2-甲基丁烯 | D. | 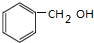 苯甲醇 苯甲醇 |
20.以NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 32gO2和32gO3的质子数均为16NA | |
| B. | 23gNa与O2在加热条件充分反应,O2得到的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含分子数为NA | |
| D. | 2 L1mol•L-1的HC1溶液中,含有的HC1分子数目为2NA |
10.某有机物A可用于合成药物达菲,其结构简式如图,下列关于A的说法不正确的是( )


| A. | 分子式为C7H6O5 | |
| B. | 和溴水既可以发生取代反应,又可以发生加成反应 | |
| C. | 1 mol该化合物最多可以与含4 mol NaOH的溶液反应 | |
| D. | 既可以和FeCl3溶液发生显色反应,又可以和NaHCO3溶液反应放出CO2气体 |
17.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
14.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是( )

| A. | 1个乙分子中含有3个A原子 | B. | 该反应类型是分解反应 | ||
| C. | 反应生成的丙物质属于单质 | D. | 化学反应中分子的种类发生了改变 |
15.设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol 甲基(-CH3)中含有的电子总数为NA | |
| B. | 标准状况下,11.2 L乙醇所含碳原子数目为NA | |
| C. | 常温常压下,26 g 苯中所含的碳碳双键数为NA | |
| D. | 23g钠在足量氧气充分燃烧,转移电子数为NA |