题目内容
20.测知某一反应进程中,各物质浓度的有关数据如下:xA(气)+yB(气)?zc(气)
起始浓度(mol/L)3.0 1.00
2s末浓度(mol/L)1.8 0.6 0.8
推算出各物质系数之比x:y:z为( )
| A. | 2:1:3 | B. | 3:1:2 | C. | 3:2:1 | D. | 9:3:4 |
分析 根据浓度变化量之比等于化学计量数之比计算解答.
解答 解:2s末时△c(A)=3mol/L-1.8mol/L=1.2mol/L、△c(B)=1mol/L-0.6mol/L=0.4mol/L、△c(C)=0.8mol/L,
浓度变化量之比等于化学计量数之比,则x:y:z=△c(A):△c(B):△c(C)=1.2mol/L:0.4mol/L:0.8mol/L=3:1:2,
故选:B.
点评 本题考查化学平衡有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
10.把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3 全部赶出.另一份需消耗含cmolBaCl2的水溶液,沉淀反应刚好完全.则原溶液中硝酸根离子的物质的量浓度为( )
| A. | $\frac{b-2c}{a}$mol.L-1 | B. | $\frac{2b-c}{a}$mol.L-1 | C. | $\frac{a-b}{a}$mol.L-1 | D. | $\frac{2b-4c}{a}$mol.L-1 |
11.氨的合成是最重要的化工生产之一.在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$ 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
(1)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$.
(2)甲容器达到平衡所需要的时间t=5min(填“>”、“<”或“=”).
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
(2)甲容器达到平衡所需要的时间t=5min(填“>”、“<”或“=”).
8.国际石油价格多次上涨,为解决能源危机,现在全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油.已知热化学方程式:$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(l)△H=-683.4kJ/mol.下列有关说法正确的是( )
| A. | 乙醇汽油是一种清洁能源,燃烧不会产生任何污染 | |
| B. | 在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 | |
| C. | 乙醇的燃烧热为683.4kJ/mol | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol |
12.下列实验操作不正确的是( )
| A. | 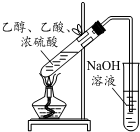 实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. |  处理尾气 | |
| D. | 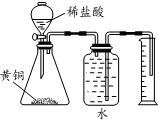 测定黄铜(Cu、Zn合金)中Zn 的含量 |
9.某同学通过系列实验探究Al及其化合物的性质,操作正确且能达到目的是( )
| A. | 将铝片加入浓硫酸中,探究Al的活泼性 | |
| B. | 将NaOH溶液缓慢滴入Al2(SO4)3溶液中,观察Al (OH)3沉淀的生成及溶解 | |
| C. | 将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将Al(OH)3沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水AlCl3固体 |
10.下列变化中需加入氧化剂才能实现的是.( )
| A. | H2SO4→BaSO4 | B. | Cl-→Cl2 | C. | CuO→Cu | D. | Fe3+→Fe2+ |