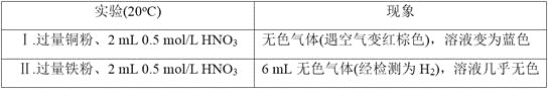
题目内容
【题目】化学计盘在化学中占有重要地位,请回答下列问题。
(1)相同质量的SO2和SO3所含氧原子的个数比为______。
(2)质量相同的A、B两种气体,在同温同压下,A的分子数比B多,则A的密度_____ B的密度(填>、=、<)。
(3)焦亚硫酸纳(Na2 S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。果脯中的Na2 S2O5的使用量是以游离的SO2来计算的,我国规定每千克果脯中SO2的最高含量是0.35g。
①下列试剂可用于检测SO2的是_________。
A.I2 B.HC1 C. H2SO4 D.CS2
②某500g果脯样品经检测得知含有SO2的物质的量为0.005 mol,该产品是否合格_________ (填“是”或“否”)。
(4)“84消毒液”是常用的含氯消毒剂,可以利用Cl2与NaOH反应制得该产品。反应的离子方程式为_______。“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制1 000 mL 0.50 mol L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_________mL。
【答案】5:6 ![]()
![]() 否
否 ![]()
![]()
【解析】
(1)同质量比较原子个数,可以找二者相对原子质量的最小公倍数,也可假设等质量为1进行计算;阿伏加德罗定律的应用一定要会进行公式的转换,找准正比、反比关系; (2)理想状态气体方程:![]() ,该题要比较分子数与密度,所以变形为:
,该题要比较分子数与密度,所以变形为:![]() ,同质量、同温度、同压强下,分子数与密度成反比;(3)要检测SO2,即能与SO2发生反应,SO2既有还原性也有氧化性;(4)稀释浓溶液,抓住反应前后溶质的物质的量不变进行计算
,同质量、同温度、同压强下,分子数与密度成反比;(3)要检测SO2,即能与SO2发生反应,SO2既有还原性也有氧化性;(4)稀释浓溶液,抓住反应前后溶质的物质的量不变进行计算![]() 。
。
(1)同质量的SO2、SO3假设其质量均为1g,则二氧化硫的物质的量为![]() ,三氧化硫的物质的量为
,三氧化硫的物质的量为![]() ,氧原子的个数比:
,氧原子的个数比:![]() :
:![]() ,约分化简为5:6;
,约分化简为5:6;
故答案为:5:6;
(2)理想状态气体方程:![]() ,该题要比较分子数与密度,所以变形为:
,该题要比较分子数与密度,所以变形为:![]() ,同质量、同温度、同压强下,分子数与密度成反比,A的分子数比B多,所以A的密度小于B的密度;
,同质量、同温度、同压强下,分子数与密度成反比,A的分子数比B多,所以A的密度小于B的密度;
故答案为:<;
(3) ①要检测SO2,即能与SO2发生反应,SO2有强还原性,所以可以和I2(做氧化剂)发生氧化还原反应,其他均不反应,故选A;②![]() 的SO2的质量为:
的SO2的质量为:![]() ,则500g的果脯中含SO2
,则500g的果脯中含SO2![]() ;
;
故答案为:A;否;
(4)氯气与氢氧化钠反应的离子方程式:![]() ;稀释浓溶液,根据反应前后溶质的物质的量不变进行计算
;稀释浓溶液,根据反应前后溶质的物质的量不变进行计算![]() ,浓溶液的浓度
,浓溶液的浓度![]() ,则
,则![]() ;
;
故答案为:![]() ;
;![]() 。
。