题目内容
【题目】铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐。服用维生素C,有利于人体对铁元素的吸收。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作 用下转化成亚铁盐。此反应的离子方程式______。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
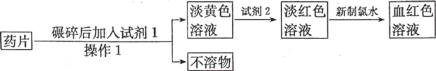
①操作1的名称是__________。
②试剂2为______溶液(填化学式)。
③加入新制氯水,溶液中发生反应的离子方程式是__________。
【答案】![]() 氧化性 过滤 KSCN
氧化性 过滤 KSCN ![]()
【解析】
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,铁粉与胃酸(盐酸)反应生成亚铁盐与氢气;(2)工业盐的主要成分是NaNO2,NaNO2把人体内的Fe2+转化为Fe3+,则亚铁离子为还原剂,所以NaNO2做氧化剂;(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。试剂1即为酸,操作1为过滤,除去不溶性杂质,呈浅黄色溶液,可能有![]() ,加入试剂2变浅红色,且再加氯水,变血红色,说明溶液中有少量的
,加入试剂2变浅红色,且再加氯水,变血红色,说明溶液中有少量的![]() ,大量的
,大量的![]() 。
。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,铁粉与胃酸(盐酸)反应生成亚铁盐与氢气,离子方程式为:![]() ;
;
故答案为:![]() ;
;
(2)工业盐的主要成分是NaNO2,NaNO2把人体内的Fe2+转化为Fe3+,则亚铁离子为还原剂,所以NaNO2做氧化剂,具有氧化性;
故答案为:氧化性;
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。试剂1即为酸,操作1为过滤,除去不溶性杂质,呈浅黄色溶液,可能有![]() ,加入试剂2变浅红色,且再加氯水,变血红色,说明溶液中有少量的
,加入试剂2变浅红色,且再加氯水,变血红色,说明溶液中有少量的![]() ,
,
大量的![]() 被氧化,与SCN-结合生成络合物,溶液变血红色;
被氧化,与SCN-结合生成络合物,溶液变血红色;
故答案为:过滤;KSCN;![]() 。
。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |
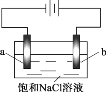
下列分析不正确的是
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH =NaCl+NaClO+H2O
C. 电解时OH- 由b极向a极移动
D. 不宜采用实验③的电压制备NaClO