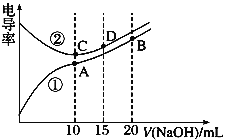
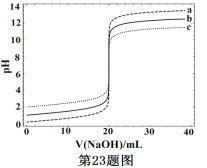
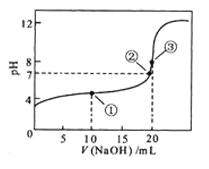
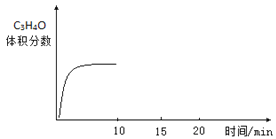
题目内容
【题目】为了防止枪支生锈,常采用化学处理使枪支的钢铁零件表面生成Fe3O4的致密保护层— “发蓝”。化学处理过程中,其中一步反应为3Fe + NaNO2+5NaOH =3Na2FeO2+H2O+NH3↑。下列叙述不正确的是
A.该处理过程不会产生污染B.上述反应中铁被氧化
C.NO2-的氧化性大于FeO22-D.反应中转移2mole-,生成还原产物![]()
【答案】AD
【解析】
在化学反应中,铁元素的化合价由零变成正二价,化合价升高了2价,铁为还原剂;氮元素的化合价从正三价变成负三价,化合价降低了6价,NaNO2做氧化剂,反应中生成1mol氨气转移6mol电子。
A.该反应产物中有氨气,具有刺激性气味,会对空气造成污染,故A错误;
B.铁的化合价由零价变成正二价,化合价升高,做还原剂被氧化,符合题意,B正确;
C.NO2-做氧化剂,FeO22-是氧化产物,氧化剂的氧化性大于氧化产物,故C正确;
D.氨气为还原产物,氮元素从正三价变成负三价,化合价降低了6价,生成1mol氨气转移6mol电子,则转移2mol电子生成氨气的物质的量为![]() mol,生成氨气的质量为
mol,生成氨气的质量为![]() ,故D错误;
,故D错误;
答案选AD。

 新课标阶梯阅读训练系列答案
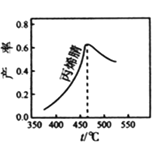
新课标阶梯阅读训练系列答案【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行