题目内容
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
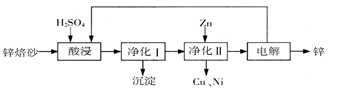
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃, 。
。
③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。

(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃,
 。
。③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。
(1)ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O;(2)①H2O2+2Fe2++2H+═2Fe3++2H2O;②4.0×10-5mol/L;③Fe(OH)3胶体具有吸附性;(3)电解制取的锌中会含有铜等杂质;
(4)H2SO4、ZnSO4。
(4)H2SO4、ZnSO4。
试题分析:(1)根据题给信息知,酸浸时ZnFe2O4会生成两种盐硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应生成硫酸锌、硫酸铁和水,化学方程式为:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O;(2)①亚铁离子被双氧水氧化成铁离子,离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O;②氢氧化铁的溶度积
Ksp[Fe( OH)3]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol/L,c(Fe3+)=4.0×10-38/(1×10-11)3=4.0×10-5mol/L;③由于生成的Fe(OH)3胶体具有吸附性,所以净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质;(3)由于锌焙砂中含有CaO、FeO、CuO、NiO等氧化物,反应后溶液中存在铜离子等杂质,没有净化Ⅱ操作,电解制取的锌中会含有铜等杂质;(4)通过制取金属锌的流程图示可以知道,可以循环利用的物质除锌外,含有H2SO4、ZnSO4。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
 M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于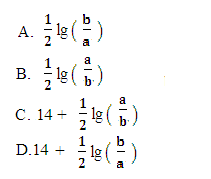

 Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3


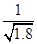 ×10—11mol?L—1
×10—11mol?L—1