题目内容
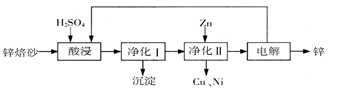
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

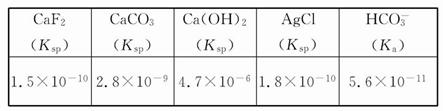
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .
(1)过滤(1分)
(2)2FeCl3 +Fe = 3FeCl2(2分); 2FeCl3 + Cu= 2FeCl2 +CuCl2(2分)
(3)Cu粉(2分)
(4)① MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O(2分) ② 0.4XY(2分)
(5)Fe3+>Cu2+>Mn2+(2分)
(6)22.4Z/64 (2分); 4OH- ―4e-=O2↑ + 4H2O(2分)
(2)2FeCl3 +Fe = 3FeCl2(2分); 2FeCl3 + Cu= 2FeCl2 +CuCl2(2分)
(3)Cu粉(2分)
(4)① MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O(2分) ② 0.4XY(2分)
(5)Fe3+>Cu2+>Mn2+(2分)
(6)22.4Z/64 (2分); 4OH- ―4e-=O2↑ + 4H2O(2分)
试题分析:根据题给流程图和信息知,废旧合金(含有Cu、Fe、Si 三种成分)与过量FeCl3溶液混合发生的反应为2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2,过滤,固体A的成分为Si,溶液a的成分为FeCl3 、FeCl2 和CuCl2的混合液;电解含Cu2+、Cl—、K+的溶液的固体B,B的成分为Cu;溶液a加过量还原剂反应后过滤得固体B(Cu),则还原剂为铜,发生的反应为2FeCl3 + Cu= 2FeCl2 +CuCl2,溶液b的成分为FeCl2 和CuCl2的混合液;溶液b中加入酸性高锰酸钾溶液,亚铁离子被氧化为铁离子,用氢氧化钾溶液调节溶液的PH,铁离子转化为氢氧化铁沉淀,灼烧的氧化铁,溶液d经处理的金属锰。(1)由流程图知,操作Ⅰ、Ⅱ、Ⅲ为分离固液混合物的操作,指的是过滤;(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2;(3)由上述分析知,过量的还原剂应是Cu粉;(4)①向溶液b中加入酸性KMnO4溶液亚铁离子被氧化为铁离子,反应的离子方程式为MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O;②根据相关反应的关系式:2MnO4-—— 10Fe2+——5Fe2O3,用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为0.4XYg;(5)根据题意知,溶液c中所含的金属阳离子为Fe3+、Cu2+和Mn2+,若三者浓度相等,向溶液c中逐滴加入KOH溶液,根据题给溶度积产生判断,Fe3+所需氢氧根浓度最小先沉淀,Mn2+所需氢氧根浓度最大,最后沉淀,则三种金属阳离子沉淀的先后顺序为:Fe3+>Cu2+>Mn2+;(6)根据题意知,电解过程的电极反应式依次为:阳极:4OH- ―4e-=O2↑ + 4H2O;阴极:Cu2+ + 2e-= Cu;2H+ + 2e- = H2↑;根据电子守恒计算,标况下阳极生成的最后一种气体体积为22.4Z/64L。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目

 。
。