题目内容
【题目】下列有关食品添加剂的说法中,正确的是( )。
A.山梨酸是一种常见的膨松剂
B.亚硝酸钠是一种常见的发色剂
C.碳酸氢钠具有碱性,是一种常见的调味剂
D.β胡萝卜素是一种人工食用色素
【答案】B
【解析】
A.山梨酸是食品防腐剂,错误;
B.亚硝酸钠是一种常见的发色剂,正确;
C.NaHCO3为食品膨松剂,错误;
D.β胡萝卜素为天然食用色素,错误;
故选B。

【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O![]() 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
【题目】在2 L密闭容器中进行反应:aX(s)+bY(g)![]() cP(g)+dQ(g),式中a、b、c、d为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
cP(g)+dQ(g),式中a、b、c、d为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | P | Q |
起始/mol | 0.5 | 1.0 | 1.5 | |
2min末/mol | 0.7 | 2.7 | 0.8 | |
3min末/mol | 2.7 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,v(P)∶v(Y)=2∶5。
(1)试确定以下物质的相关量:起始时n(Y)=______,2min末时n(Q)=______。
(2)上述反应的化学方程式为_________
(3)用Y表示2 min内的反应速率为______。2min末,Q在混合气体的体积分数为_____
(4)在保持温度和容积不变的情况下,下列关于上述反应的叙述不正确的是_____
a.2 min内用X表示的反应速率为0.05mol·L-1·min-1
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了_________________。
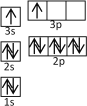
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由________________。
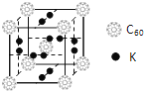
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为______。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。
