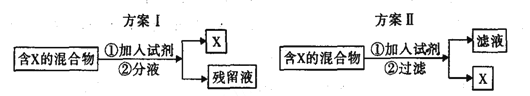
题目内容
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O![]() 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
【答案】54.3 500mL容量瓶、胶头滴管 2Cr3++3H2O2+H2O=Cr2O72-+8H+ Fe(OH)3、 Al(OH)3 Na+、 SO42-、 CrO42- Mg2+、 Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-
【解析】
(1)实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需用500mL容量瓶,根据稀释前后硫酸物质的量不变,列式计算需量取浓硫酸的体积;定容时用容量瓶和胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,根据得失电子守恒配平方程式;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀;(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,分析利用钠离子交换树脂可除去滤液II中的金属阳离子;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4。
(1)实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需用500mL容量瓶;设需量取浓硫酸的体积为vmL,根据稀释前后硫酸物质的量不变,18.4mol/L![]() =500mL
=500mL![]() 2mol/L,v=54.3mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,反应离子方程式是2Cr3++3H2O2+H2O=Cr2O72-+8H+;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀,所以过滤II操作得到的滤渣主要为Fe(OH)3、 Al(OH)3;根据元素守恒,滤液II中含有的离子主要有Na+、 SO42-、 CrO42-;(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,利用钠离子交换树脂可除去滤液II中的金属阳离子有Mg2+、 Ca2+;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4,反应离子方程式是2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。
2mol/L,v=54.3mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,反应离子方程式是2Cr3++3H2O2+H2O=Cr2O72-+8H+;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀,所以过滤II操作得到的滤渣主要为Fe(OH)3、 Al(OH)3;根据元素守恒,滤液II中含有的离子主要有Na+、 SO42-、 CrO42-;(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,利用钠离子交换树脂可除去滤液II中的金属阳离子有Mg2+、 Ca2+;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4,反应离子方程式是2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。

【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于250 mL容量瓶中,加入蒸馏水溶解,定容至刻度线即可。 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
D | 制备Fe(OH)3胶体 | 通常是将Fe(OH)3固体溶于热水中即可 |
A. A B. B C. C D. D