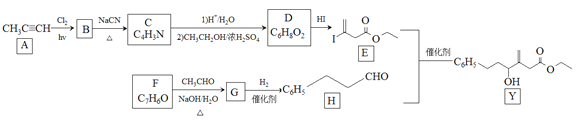
题目内容
【题目】2018年12月7日12时12分,我国成功的用长征二号丁运载火箭将沙特等国的12颗卫星一次性送入预定轨道,标志着我国一箭多星发射技术已经达到国际领先水平。火箭推进器常用强还原剂液态肼(N2H4)和强氧化剂液态双氧水来产生推力。
(1)已知肼分子中每个原子的最外层电子都达到了稳定结构,请写出肼的结构式:________。
(2)肼-空气燃料电池是一种环保的碱性燃料电池,电解质溶液是20%~30%的KOH溶液.
肼-空气燃料电池放电时负极的电极反应式是________________________。
(3)由18O、16O、H、D原子组成的H2O2分子共有10种,这10种分子中共有_______种相对分子质量。
(4)一种用H2O2处理剧毒物质NaCN的化学方程式是NaCN+H2O2→N2↑+X+H2O,则X的化学式是____________。
(5)强氧化剂液态H2O2也可以用NO2、或F2代替,试写出N2H4与F2的化学反应方程式_________。
【答案】![]() N2H4-4e-+4OH-=N2↑+4H2O 7种 NaHCO3 N2H4+2F2=N2+4HF
N2H4-4e-+4OH-=N2↑+4H2O 7种 NaHCO3 N2H4+2F2=N2+4HF
【解析】
(1)根据共价键成键规律作答;
(2)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答;
(3)根据氢原子有2种同位素和氧原子有两种同位素进行判断;
(4)依据电子转移数守恒和元素守恒规律作答;
(5)依据氧化还原反应的规律作答。
(1)已知N2H4分子内所有原子的最外层都达到了稳定结构,N最外层5个电子可以形成3个单键,H最外层1个电子只能形成一个单键,则它的结构式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)肼空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH4e=4H2O+N2,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e=4OH,故答案为:N2H4-4e-+4OH-=N2↑+4H2O;
(3)氢原子有三种同位素H、D,氧原子有两种同位素18O、16O,故组成的H2O2分子可能为:H218O2、H216O2、H218O16O、D218O2、D216O2、D218O16O、HD18O2、HD16O2、HD18O16O和HD16O19O共10种,其相对分子质量分别为:38、34、36、40、36、38、39、35、37和37,则种类数有7种;
(4)NaCN种C为+2价,N为-3价,则NaCN+H2O2→N2↑+X+H2O反应中,N元素化合价从-3升高到0价,升高6,C元素化合价由+2价升高到+4价,O元素从-1价降低到-2价,降低2,根据电子得失守恒可知NaCN 与H2O2的物质的量之比为2:5,再根据元素守恒定律可知,X为NaHCO3;
(5)F2将N2H4氧化生成氮气和HF,其化学方程式为:N2H4+2F2=N2+4HF。

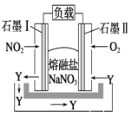
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
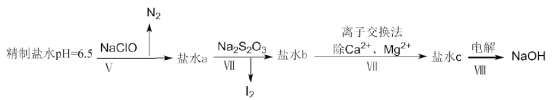
①过程V生成N2的离子方程式为__________。
②过程Ⅳ可以通过控制Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol·L-1的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
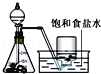
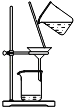
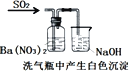
【题目】下列实验对应的结论正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 用浓盐酸与二氧化锰制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀一定是BaSO4 |
A. A B. B C. C D. D