题目内容
10.130mol浓度为3mol•L-1是盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )| A. | 加入适量的6mol•L-1的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入数滴硝酸铜溶液 | D. | 加入适量的氯化钠溶液 |
分析 一定浓度盐酸和过量锌片反应,要加快反应速率,但不影响生成氢气总量,可以通过增大氢离子浓度、升高温度、形成原电池等方法,但不能增大氢离子的物质的量,据此分析解答.
解答 解:一定浓度盐酸和过量锌片反应,要加快反应速率,但不影响生成氢气总量,可以通过增大氢离子浓度、升高温度、形成原电池等方法,但不能增大氢离子的物质的量,
A.加入较浓的盐酸,氢离子浓度增大,反应速率增大,但因为氢离子的物质的量增大,所以影响生成氢气总量,故A错误;
B.加入氯化铜溶液,Zn置换出Cu,Zn、Cu和稀盐酸构成原电池而加快反应速率,且不影响生成氢气总量,故B正确;
C.加入硝酸铜溶液,Zn能置换出Cu,但酸性条件下,硝酸根离子具有强氧化性,能生成NO,产生杂质气体,故C错误;
D.加入适量氯化钠溶液,离子浓度降低,反应速率降低,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,可以通过改变浓度、温度等方法改变反应速率,但要注意结合题给限制性条件,易错选项是C.

练习册系列答案
相关题目
20.下列球棍模型表示的是异丁烷的是( )
| A. |  | B. |  | C. |  | D. | 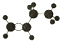 |
5.下列物质中,不含共价键的是( )
| A. | Na2S | B. | NH3 | C. | HClO | D. | Na2O2 |
2.下列有关氧化还原反应的叙述正确的是( )
| A. | 粮食酿酒经历淀粉→葡萄糖→乙醇,每一步均发生氧化还原反应 | |
| B. | 具有氧化性的物质在氧化还原反应中一定作氧化剂 | |
| C. | 在某些反应中可能所有元素的化合价都发生变化 | |
| D. | 单质甲能从盐溶液中置换出单质乙,单质甲一定发生氧化反应 |
19.化学与生产、生活、社会密切相关,下列叙述错误的是( )
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| B. | 工业燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若同时使用硫酸亚铁和氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 航天服的主要成分是碳化硅、陶瓷和碳纤维,它们都属于无机非金属材料 |
20.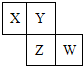 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
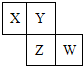 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 非金属性:W>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:X>Y>Z | |
| D. | 最高正化合价:W>Z>X |
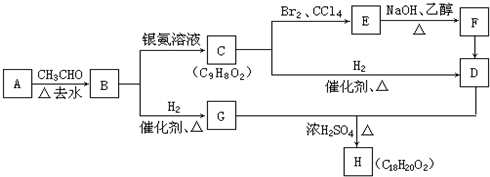
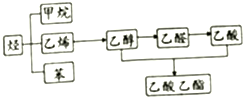 如图是几种重要的有机物及部分转化关系,请回答下列问题:
如图是几种重要的有机物及部分转化关系,请回答下列问题: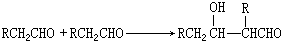
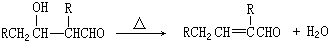
 ;
; +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$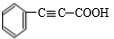 +2NaBr+2H2O
+2NaBr+2H2O +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$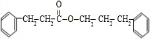 +H2O.
+H2O.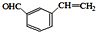 、
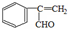
、 、
、
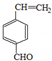 .
.