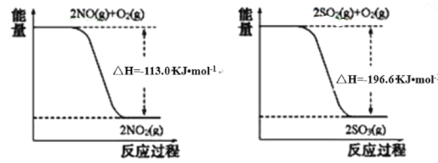
��Ŀ����
����Ŀ���������ʽṹ�й����ʺ��ص㣬�ش��������⣺
��1��Ti��̬ԭ�Ӻ�������Ų�ʽΪ _____��̬��ԭ�Ӻ����������״��_________�������ƣ���
��2����ϩ�棨CH2=CH-CN��������������![]() ���ĸ�����Ϊ_____,������̼ԭ�ӹ�����ӻ�������___
���ĸ�����Ϊ_____,������̼ԭ�ӹ�����ӻ�������___
��3��д����NH4+��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ______��_______��
��4���Ѵ�������ͬ���칹�壬![]() �����������ܶѻ���
�����������ܶѻ���![]() �������������ѻ������������Ѿ��������_____������
�������������ѻ������������Ѿ��������_____������![]() ת��Ϊ
ת��Ϊ![]() �������_____��������������������������
�������_____��������������������������
��5������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����____________����������
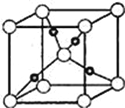
��6��Cu��OԪ���γɵ�ij�ֻ�����ľ����ṹ��ͼ��ʾ����������ԭ�ӵ���λ��Ϊ____��������٤������ΪNA�������ı߳�Ϊa pm,�þ�����ܶ�Ϊ__gcm��3��
���𰸡�1s22s22p63s23p63d24s2��[Ar] 3d24s2 ���Ρ������� 2:1 sp2 sp CH4 BH4- X-�������� ���� ������ 4 ![]()
��������
��1��Ti��22��Ԫ�أ����ݺ�������Ų����ɣ���д�����Ų�ʽ������Alԭ�Ӻ�������Ų�ʽȷ������̬��ԭ�Ӻ����������״��
��2����ϩ�����������ԭ�Ӷ���ͬһƽ����,���ϩ�������,̼ԭ�ӵ��ӻ����������sp2�ӻ���sp�ӻ�,�����������ĸ�����Ϊ2��1��
��3���ȵ�������ָ������ͬ�۵�����Ŀ��ԭ����Ŀ�ķ��ӻ����ӣ���NH4+Ϊ�ȵ�������������8���۵��ӣ�5��ԭ�ӣ�
��4��������Ķѻ���ʽ�ķ�����x-�������䣬�������ܶѻ��ռ������ʱ����������ѻ��ռ������ʸߣ���![]() ת��Ϊ
ת��Ϊ![]() ����������ͣ�
����������ͣ�
��5���õ��������������������ԭ�Ӻ�����ֵĸ����ܶȷֲ���
��6���ӽṹ���������ݾ�����ԭ�Ӹ����ļ��㷽����ȷ���������ͣ������ܶȡ�
��1��Ti��22��Ԫ�أ�����������Ų����ɣ�Tiԭ�Ӻ�������Ų�ʽΪ��1s22s22p63s23p63d24s2��[Ar] 3d24s2������Al��13��Ԫ�أ�ԭ�Ӻ�������Ų�ʽ��1s22s22p63s23p1����̬��ԭ�Ӻ����������״�У����Ρ����������֣������Ϊ��1s22s22p63s23p63d24s2��[Ar] 3d24s2 �����Ρ������Σ�
��2����ϩ�����������ԭ�Ӷ���ͬһƽ����,���ϩ�������,̼ԭ�ӵ��ӻ����������sp2�ӻ���sp�ӻ�,�����������ĸ�����Ϊ2��1�������Ϊ��2:1��sp2 sp��
��3���ȵ�������ָ������ͬ�۵�����Ŀ��ԭ����Ŀ�ķ��ӻ����ӣ���NH4+Ϊ�ȵ�������������8���۵��ӣ�5��ԭ�ӣ����NH4+��Ϊ�ȵ�����ķ����磺CH4�������磺BH4-�������Ϊ��CH4 ��BH4-��
��4��������Ķѻ���ʽ�ķ�����x-�������䣬�������ܶѻ��ռ������ʱ����������ѻ��ռ������ʸߣ���![]() ת��Ϊ
ת��Ϊ![]() ����������ͣ������Ϊ��x-�������䣻���ͣ�
����������ͣ������Ϊ��x-�������䣻���ͣ�
��5���õ��������������������ԭ�Ӻ�����ֵĸ����ܶȷֲ��������Ϊ�������ƣ�
��6��λ�ھ��������8��ԭ�ӣ�ÿ��ԭ�����ھ�����ֻ��1/8�����Ըþ����У���ԭ�Ӹ���Ϊ1+8![]() =2����ɫԭ����4�������Ը�������Cu2O���þ�������2��Cu2O���ʾ�������Ϊ144
=2����ɫԭ����4�������Ը�������Cu2O���þ�������2��Cu2O���ʾ�������Ϊ144![]() 2NA,���������Ϊ(a
2NA,���������Ϊ(a![]() )3cm3�����Ըþ������ܶ�Ϊ��
)3cm3�����Ըþ������ܶ�Ϊ��![]() g/cm3���ʱ����Ϊ��4��
g/cm3���ʱ����Ϊ��4��![]() ��
��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�