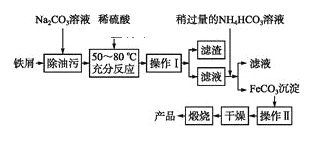
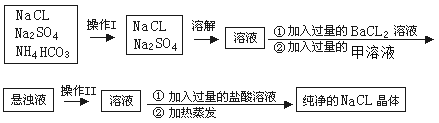
题目内容
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,请回答下列问题:
(1)XZ2的分子式为__________,分子的立体构型为__________。
(2)YZ2的电子式为__________,其分子中含有__________条![]() 键,__________条π键。
键,__________条π键。
(3)Q的元素符号是__________,属于__________区,它的核外电子排布式为__________。价电子排布图为__________,在形成化合物时它最高的化合价为__________。
(4)E的单质与水反应的化学方程式为__________。
【答案】SO2 V型 ![]() 2 2 Cr d区 ls22s22p63s23p63d54s1
2 2 Cr d区 ls22s22p63s23p63d54s1 ![]() +6 2F2+2H2O=4HF+O2
+6 2F2+2H2O=4HF+O2
【解析】
X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,则Z为O元素,Q的核电荷数是X与Z的核电荷数之和,Q原子序数=16+8=24,故Q为Cr元素;E在元素周期表的各元素中电负性最大,则E为F元素。据此分析解答。
根据上述分析,X为S元素,Y为C元素,Z为O元素,Q为Cr元素,E为F元素。
(1)XZ2的分子式为SO2,其中S原子的价层电子对数=2+![]() =3,采用sp2杂化,分子的立体构型为V型,故答案为:SO2;V型;
=3,采用sp2杂化,分子的立体构型为V型,故答案为:SO2;V型;
(2)CO2为直线形分子,电子式为![]() ,其中含有2条
,其中含有2条![]() 键2条π键,故答案为:
键2条π键,故答案为:![]() ;2;2;
;2;2;
(3)Q为Cr元素,原子序数为24,核外电子排布式为1s22s22p63s23p63d54s1,属于d区元素;价电子排布图为![]() ,最高化合价为+6价,故答案为:Cr;d区;ls22s22p63s23p63d54s1;
,最高化合价为+6价,故答案为:Cr;d区;ls22s22p63s23p63d54s1;![]() ;+6;
;+6;
(4)氟气与水反应的化学方程式为2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2。