题目内容
【题目】工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g)![]() 2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。
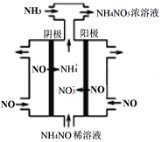
①其阴极的电极反应式为___________。
②常温下,1L pH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=________mol·L-1。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
【答案】4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.0 kJ·mol-1 > AD ![]() 1×10-6 < 16
1×10-6 < 16
【解析】
(1)根据盖斯定律书写氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式;
(2) ①合成氨反应为放热反应,升高温度,平衡逆向移动;
②根当正逆反应速率相等,各物质浓度保持不变,反应达到化学平衡状态;
(3) ①阴极得电子发生还原反应;②根据质子守恒:NH4NO3溶液中c(NH3·H2O)+c(OH-)= c(H+);
(4)平衡常数K=![]() ;根据Q、K的关系判断V正、V逆的关系。
;根据Q、K的关系判断V正、V逆的关系。
(1)将已知反应依次编号为①②③,由盖斯定律,①×2-②×2+③×3得氨气经催化氧化完全生成一氧化氮和水蒸气的方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g),则△H=[(+180.5kJ·mol-1)×2-(-92.4kJ.mol-1)×2+(-483.6kJ·mol-1)×3]=-905.0kJ·mol-1 ,故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.0 kJ·mol-1;
(2)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数K减小,则K1>K2,故答案为:>;
②A、2v(H2)(正)=3v(NH3)(逆)说明正反应速率等于逆反应速率,达到平衡状态,故正确;
B、2v(N2) (正)=v(H2) (逆)不能说明反应正反应速率等于逆反应速率,没有达到平衡状态,故错误;
C、恒温恒压下,无论是否达到平衡,容器内压强始终保持不变,反应不一定达到平衡状态,故错误;
D、由质量守恒定律可知,平衡前后气体质总量不变,该反应是气体体积减小的反应,反应时容器体积变小,混合气体密度增大,混合气体的密度保持不变说明反应正反应速率等于逆反应速率,达到平衡状态,故正确;
正确选项为AD,故答案为:AD;
(3) ①电解时,阴极上发生还原反应,根据示意图可知,酸性条件下,NO在阴极得电子发生还原反应生成NH4+,电极反应式为NO+5e-+6H+=NH4++H2O,故答案为:NO+5e-+6H+=NH4++H2O;
②pH=6的NH4NO3溶液中,c(H+)=1×10-6 mol·L-1,根据质子守恒:NH4NO3溶液中c(NH3·H2O)+
c(OH-)=c(H+)=1×10-6mol·L-1,故答案为:1×10-6;
(4)由方程式可知,平衡常数K=![]() ,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1,则K=
,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1,则K=![]() =16;T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,设容器体积为VL,由同温同压下,体积比等于物质的量比可得关系式:
=16;T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,设容器体积为VL,由同温同压下,体积比等于物质的量比可得关系式:![]() =
=![]() ,解得V=8L,此时c(NH3)=
,解得V=8L,此时c(NH3)=![]() mol·L-1,c(CO2)=
mol·L-1,c(CO2)=![]() mol·L-1,浓度熵Qc=
mol·L-1,浓度熵Qc=![]() =
=![]() =20.48>K,反应逆向进行,故有V正<V逆,故答案为:<;16。
=20.48>K,反应逆向进行,故有V正<V逆,故答案为:<;16。