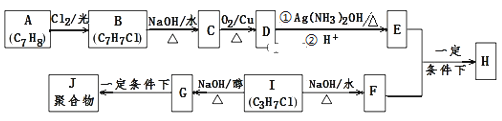
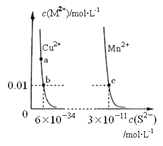
题目内容
【题目】氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。
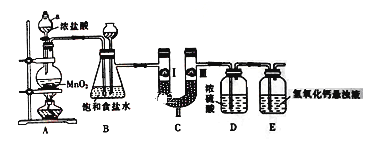
(1) 仪器a的名称为_______________。
(2) 装置B中饱和食盐水的作用是_________________;
(3) 写出A装置中发生反应的化学方程式______________________
(4) 装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入__________(填字母)。
选项 | a | b | c |
I | 湿润的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5) 装置E中氢氧化钙悬浊液的作用是___________________,同时该装置工业上可用来制取漂白粉,请写出相应反应的化学方程式:___________________。
【答案】分液漏斗 除去HCl MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O c 吸收尾气 2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
MnCl2+Cl2↑+2H2O c 吸收尾气 2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
【解析】
(1)由仪器a的结构分析解答;
(2)制备的氯气中含有HCl,结合氯气和氯化氢的性质分析饱和食盐水的作用;
(3)依据实验室制取氯气的试剂和反应产物书写化学方程式;
(4)通过Ⅰ、Ⅲ的有色布条对比验证,Ⅱ处为干燥剂,只能为固体干燥剂且不能与氯气反应,D中浓硫酸防止E中水蒸气进入C中;
(5)氯气有毒,氢氧化钙溶液吸收氯气,防止污染环境。
(1)由仪器a的结构可知,a为分液漏斗,故答案为:分液漏斗;
(2)盐酸易挥发,制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl气体,故答案为:除去Cl2中的HCl气体;
(3)制备氯气选用的药品为固体二氧化锰和浓盐酸,加热时反应的化学反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)通过Ⅰ、Ⅲ的有色布条对比验证,Ⅱ处为干燥剂,只能为固体干燥剂且不能与氯气反应,D中浓硫酸防止E中水蒸气进入C中,装置C中Ⅰ、Ⅱ、Ⅲ处依次放入湿润的有色布条、氯化钙、干燥的有色布条,故选c;
(5)氯气有毒,装置E中氢氧化钙可以吸收多余的Cl2,防止污染空气,反应化学方程式为:2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O,故答案为:吸收多余的Cl2,防止污染空气;2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
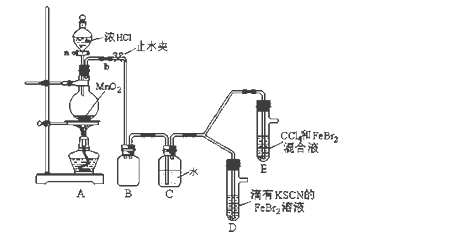
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________