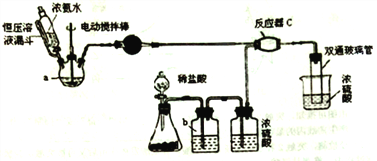
题目内容
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
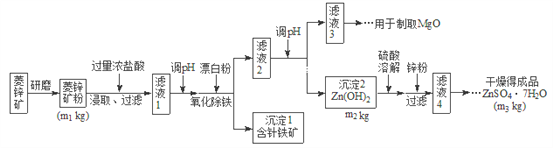
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示
【答案】 增大反应物接触面积或增大反应速率或使反应更充分 Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+ ![]() bd 蒸发浓缩 冷却结晶 125m2
bd 蒸发浓缩 冷却结晶 125m2![]() 1
1
【解析】考查化学工艺流程,(1)将棱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分;(2)Fe3+为弱碱根离子,水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+;(3)滤液2中调节pH,得到滤液3和Zn(OH)2,即Mg2+不能出现沉淀,Zn(OH)2不溶解,因此pH的区间为
Fe(OH)3+3H+;(3)滤液2中调节pH,得到滤液3和Zn(OH)2,即Mg2+不能出现沉淀,Zn(OH)2不溶解,因此pH的区间为![]() ;(4)a、大理石不溶于水,无法让Mg2+转化成Mg(OH)2,故a错误;b、加入石灰乳,利用氢氧化镁比Ca(OH)2更难溶的性质,将Mg2+转化成Mg(OH)2,故b正确;c、纯碱与Mg2+反应生成MgCO3,MgCO3的溶解度大于Mg(OH)2,故c错误;d、Mg2+能够转化成Mg(OH)2,故d正确;(5)得到ZnSO4·7H2O,一般采用方法是蒸发浓缩、冷却结晶;(6)Zn(OH)2中锌的物质的量为m2×103/99mol,根据原子守恒,棱锌矿中锌原子物质的量至少为m2×103/99mol,即ZnCO3的物质的量至少为m2×103/99mol,即质量为125×m2×103/99g,质量分数为
;(4)a、大理石不溶于水,无法让Mg2+转化成Mg(OH)2,故a错误;b、加入石灰乳,利用氢氧化镁比Ca(OH)2更难溶的性质,将Mg2+转化成Mg(OH)2,故b正确;c、纯碱与Mg2+反应生成MgCO3,MgCO3的溶解度大于Mg(OH)2,故c错误;d、Mg2+能够转化成Mg(OH)2,故d正确;(5)得到ZnSO4·7H2O,一般采用方法是蒸发浓缩、冷却结晶;(6)Zn(OH)2中锌的物质的量为m2×103/99mol,根据原子守恒,棱锌矿中锌原子物质的量至少为m2×103/99mol,即ZnCO3的物质的量至少为m2×103/99mol,即质量为125×m2×103/99g,质量分数为![]() 2
2![]() 1。
1。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。