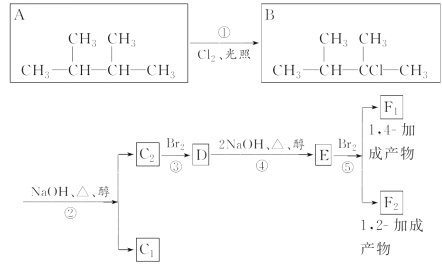
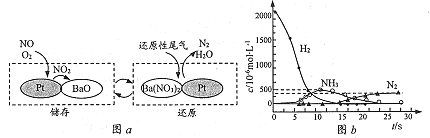
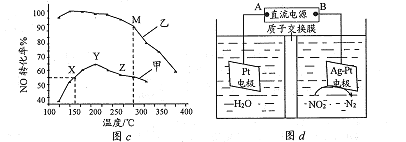
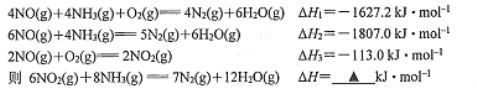题目内容
【题目】需要配制500 mL 0.5 mol·L-1氢氧化钠溶液,经测定实际所配氢氧化钠溶液的浓度为0.45 mol·L-1。可能的原因是( )
A. 转移时溶液没有冷却至室温 B. 容量瓶没有烘干
C. 称量氢氧化钠固体时砝码放反了 D. 定容时仰视读数
【答案】D
【解析】
0.45mol/L<0.5mol/L,即操作失误使所配溶液浓度偏小;根据公式cB=![]() 分析,操作失误使nB偏大或V(aq)偏小,会使所配溶液浓度偏大,反之偏小。
分析,操作失误使nB偏大或V(aq)偏小,会使所配溶液浓度偏大,反之偏小。
0.45mol/L<0.5mol/L,即操作失误使所配溶液浓度偏小;
A项,NaOH溶于水放热,转移时溶液没有冷却至室温,根据“热胀冷缩”原理,冷却后溶液体积偏小,所配溶液浓度偏大,不符合题意;
B项,容量瓶没有烘干,对所配溶液浓度无影响,不符合题意;
C项,配制500mL0.5mol/LNaOH溶液需要称量NaOH固体的质量为m(NaOH)=0.5mol/L×0.5L×40g/mol=10.0g,称量时不需要使用游码,称量NaOH固体时砝码放反了对所配溶液的浓度无影响,不符合题意;
D项,定容时仰视读数,所配溶液体积偏大,所配溶液浓度偏小,符合题意;
答案选D。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。
(1)乙醇、乙酸和浓硫酸的加入顺序是___________。制取乙酸乙酯的反应原理为:__________________________________。

(2)为证明浓硫酸在该反应中起到了______和________的作用, 为证明其作用,某同学利用上图所示装置进行了以下四个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
实验编 号 | 试管I中的试剂 | 试管II中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL18mo/L浓硫酸 | 5.0 | |
B | 3mL乙醇、2mL乙酸 | 饱和碳酸钠溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_____mL和_____mol/L。
②分析实验_______(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___________。
(3)饱和碳酸钠溶液的作用是溶解没有反应的乙醇,除去没有反应的乙酸和___________,本实验装置有明显的缺陷,其可能造成的后果是__________________________。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,一个可能的原因是_______________。
(5)分离饱和碳酸钠溶液和乙酸乙酯的方法是_________。