题目内容
8.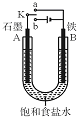 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题.(1)若开始时开关K与a连接,则B极的电极反应式为Fe-2e-=Fe2+;若在两极附近分别滴加几滴酚酞,则A极附近现象为A极附近溶液变红色.
(2)若开始时开关K与b连接,则总反应的离子方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;有关上述实验,下列说法正确的是(填序号)①②.
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)若开始时开关K与b连接,通电开始后,阴极附近溶液pH会增大,请简述原因由于氢离子在阴极放电,促进了水的电离,导致溶液中OH-浓度增大.
分析 (1)若开始时开关K与a连接,则形成原电池反应,为铁的吸氧腐蚀;
(2)若开始时开关K与b连接,形成电解池装置,石墨为阳极,发生氧化反应生成氯气,铁为阴极,发生还原反应生成氢气和氢氧化钠,以此解答;
(3)K与b连接,通电开始后,由于氢离子在阴极放电,促进了水的电离,导致溶液中OH-浓度增大.
解答 解:(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,A极上氧气得电子被还原,电极方程式为O2+2H2O+4e-=4OH-,所以在两极附近分别滴加几滴酚酞,则A极附近现象为A极附近溶液变红色;
故答案为:Fe-2e-=Fe2+;A极附近溶液变红色;
(2)①开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,总反应为电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
①溶液中Na+向阴极B极移动,故正确;
②从A极处逸出的气体为氯气能使湿润KI淀粉试纸变蓝,故正确
③电解饱和食盐水实质为电解氯化氢,因为盐酸为氯化氢的水溶液,所以反应一段时间后加适量盐酸不可恢复到电解前电解质的浓度,故错误;
④因为B为阴极,产生氢气,所以若标准状况下B极产生2.24L气体,则电路中转移0.2mol电子,但溶液中不转移电子,故错误;
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;①②;
③若标准状况下B极产生2.24L氢气,即0.1mol氢气,由2H++2e-=H2↑可知转移0.2mol电子,
故答案为:0.2(1)Fe-2e-=Fe2+;A极附近溶液变红色
(3)K与b连接,通电开始后形成电解池,由于氢离子在阴极放电,促进了水的电离,导致溶液中OH-浓度增大,故答案为:由于氢离子在阴极放电,促进了水的电离,导致溶液中OH-浓度增大.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.

 53随堂测系列答案
53随堂测系列答案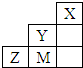
| A. | 非金属性:Y>M>Z | |
| B. | Y、Z、M的氢化物分子各原子最外层均满足8e-稳定结构 | |
| C. | 原子半径:M>Z>Y | |
| D. | Y 的最高价氧化物的水化物的化学式为HYO4 |
| A. |  和 和 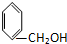 | B. | 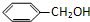 和 和 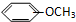 | ||
| C. | (CH3)2C(OH)CH2CH3 和CH3CH2OH | D. | CH3CH2OH 和 CH3CH2OCH2CH3 |
| A. | 铝与稀盐酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
| A. | 68.3% | B. | 74.2% | C. | 92.2% | D. | 78.1% |
| A. | 乙烯在氧气中燃烧时放出热量,因此常用它来焊接或切割金属 | |
| B. | 乙二醇和丙三醇都是无色、黏稠、有甜味的液体,常用于配制化妆品 | |
| C. | 油脂在碱性条件下水解出的甘油常用于生产肥皂 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
 实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图: