题目内容
12.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下: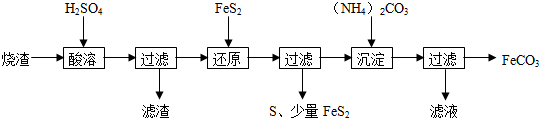
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是氢氧化铁.
(3)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++S2-=2Fe2++S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
分析 烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵,
(1)检验Fe3+常用KSCN溶液,看溶液是否呈血红色;
(2)过滤得碳酸亚铁,滤液中有硫酸铵,所以检验FeCO3是否洗净,就是检验洗涤滤液中是否有硫酸根离子;“沉淀”时,pH过高时溶液中的亚铁离子会生成氢氧化亚铁,进而生成氢氧化铁,据此答题;
(3)①根据流程可知,“还原”时反应Ⅱ有硫产生,应为硫离子与铁离子之间的氧化还原反应,据此书写反应的离子方程式;
②根据表可知,反应Ⅰ中生成的硫酸根的浓度为0.2mol•L-1,据此计算出反应Ⅰ中被还原的Fe3+的物质的量,同时计算出生成的亚铁离子的浓度,两个反应中共生成的亚铁离子的浓度为2.4mol•L-1,可求得反应Ⅱ中生成的亚铁离子,进而计算出Ⅰ、Ⅱ中被还原的Fe3+的物质的量浓度,据此答题.
解答 解:烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵,
(1)检验Fe3+常用KSCN溶液,看溶液是否呈血红色,所以检验Fe3+是否反应完全的试剂为KSCN溶液,
故答案为:KSCN溶液;
(2)过滤得碳酸亚铁,滤液中有硫酸铵,所以检验FeCO3是否洗净,就是检验洗涤滤液中是否有硫酸根离子,所以操作为取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净,“沉淀”时,pH过高时溶液中的亚铁离子会生成氢氧化亚铁,进而生成氢氧化铁,
故答案为:取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净;氢氧化铁;
(3)①根据流程可知,“还原”时反应Ⅱ有硫产生,应为硫离子与铁离子之间的氧化还原反应,反应的离子方程式为2Fe3++FeS2=3Fe2++2S↓,
故答案为:2Fe3++FeS2=3Fe2++2S↓;
②根据表可知,反应Ⅰ中生成的硫酸根的浓度为0.2mol•L-1,据反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+可知,反应Ⅰ中被还原的Fe3+的物质的量浓度为1.4mol•L-1,同时计算出生成的亚铁离子的浓度为1.5mol•L-1,两个反应中共生成的亚铁离子的浓度为2.4mol•L-1,所以反应Ⅱ中生成的亚铁离子浓度为0.9mol•L-1,根据2Fe3++S2-=2Fe2++S↓可知,Ⅱ中被还原的Fe3+的物质的量浓度为0.6mol•L-1,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为1.4mol•L-1:0.6mol•L-1=7:3,
答:反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为7:3.
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、化学计算等,需要学生熟练掌握元素化合物知识,(3)中计算为易错点、难点,能较好的考查学生分析计算能力.

| 序列 | 参加反应的物质 | 生成物 |
| ① | Cl2、FeBr2 | FeCl3、FeBr3 |
| ② | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 … |
| ③ | MnO4- … | Cl2、Mn2+ … |
| A. | 第①组反应中Cl2与 FeBr2的物质的量之比为1:2 | |
| B. | 第②组反应的其余产物为H2O和 O2 | |
| C. | 氧化性由强到弱顺序MnO4->Cl2>Fe3+>Br2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
| A. | 2mol氖气中含有2NA个原子 | |
| B. | 24g Mg失去NA个电子形成Mg2+ | |
| C. | 标准状况下11.2L的H2O中含有0.5 NA个分子 | |
| D. | 22.4LCO2含有2NA个氧原子 |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 二氧化硫与足量氢氧化钠溶液反应 SO2+2OHˉ=SO32-+H2O | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-═2A1O${\;}_{2}^{-}$+H2↑ |
| A. | 该反应是置换反应 | |
| B. | Cl2是氧化剂 | |
| C. | Fe(OH)3发生还原反应 | |
| D. | 该反应每转移6mol电子,消耗3molCl2 |

