题目内容
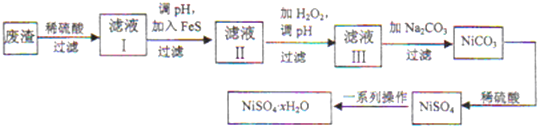
18.已知甲酸铜遇水易水解而具有还原性.实验室制备甲酸铜晶体[Cu(HCOO)2•4H2O]的流程如下:
请回答下列问题:
(1)研磨时应该将固体原料放在(填仪器名称)研钵中;制备Cu2(OH)2CO3时需要用到70℃~80℃的热水溶解小苏打和胆矾的混合物,其目的是加快反应速率,并防止NaHCO3分解.
(2)写出用小苏打、胆矾制备Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+3CO2↑+H2O;
实际操作中的小苏打与胆矾的物质的量之比大于2:1,原因是NaHCO3易分解、过量的NaHCO3可以维持碱性.
(3)操作a的名称是过滤.
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净的实验方法是取最后滤出的洗涤液少许于试管中,加入BaCl2(或其它含Ba2+溶液)溶液,若无明显现象(或“无白色沉淀”),说明已洗涤干净.
(5)实验中用无水乙醇洗涤产物的目的是减少甲酸铜晶体的损失.
分析 胆矾与小苏打研磨后在70℃~80℃的热水中溶解得到Cu2(OH)2CO3,反应的化学方程式为:2[CuSO4•5H2O]+4NaHCO3═Cu2(OH)2CO3↓+2Na2SO4+11H2O+3CO2↑,过滤、洗涤提碱式碳酸铜固体,碱式碳酸铜固体与甲酸在50℃的热水中搅拌,趋热过滤,将滤液冷却,再减压过滤,并用无水乙醇洗涤得甲酸铜晶体,
(1)研磨固体应在研钵中进行,适当加热可以加快反应速率,但要防止碳酸氢钠分解,所以可以用70℃~80℃的热水溶解小苏打和胆矾的混合物;
(2)小苏打、胆矾反应生成Cu2(OH)2CO3、硫酸钠和二氧化碳,根据电荷守恒和元素守恒书写离子方程式;由于碳酸氢钠易分解,所以反应中碳酸氢钠要过量一点,同进过量的碳酸氢钠可以使溶液维持碱性;
(3)操作a是分离固体和液体的操作;
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净可以根据洗涤滤液中没有硫酸根离子判断;
(5)甲酸铜能溶于水,洗涤时要减少甲酸铜的损失,据此选择洗涤试剂;
解答 解:胆矾与小苏打研磨后在70℃~80℃的热水中溶解得到Cu2(OH)2CO3,反应的化学方程式为:2[CuSO4•5H2O]+4NaHCO3═Cu2(OH)2CO3↓+2Na2SO4+11H2O+3CO2↑,过滤、洗涤提碱式碳酸铜固体,碱式碳酸铜固体与甲酸在50℃的热水中搅拌,趋热过滤,将滤液冷却,再减压过滤,并用无水乙醇洗涤得甲酸铜晶体,
(1)研磨固体应在研钵中进行,适当加热可以加快反应速率,但要防止碳酸氢钠分解,所以可以用70℃~80℃的热水溶解小苏打和胆矾的混合物,
故答案为:研钵;加快反应速率,并防止NaHCO3分解;
(2)小苏打、胆矾反应生成Cu2(OH)2CO3、硫酸钠和二氧化碳,反应的离子方程式为2Cu2++4HCO3-=Cu2(OH)2CO3↓+3CO2↑+H2O;由于碳酸氢钠易分解,所以反应中碳酸氢钠要过量一点,同进过量的碳酸氢钠可以使溶液维持碱性,
故答案为:2Cu2++4HCO3-=Cu2(OH)2CO3↓+3CO2↑+H2O;NaHCO3易分解、过量的NaHCO3可以维持碱性;
(3)操作a是分离固体和液体的操作,可以用过滤,
故答案为:过滤;
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净可以根据洗涤滤液中没有硫酸根离子判断,方法是取最后滤出的洗涤液少许于试管中,加入BaCl2(或其它含Ba2+溶液)溶液,若无明显现象(或“无白色沉淀”),说明已洗涤干净,
故答案为:取最后滤出的洗涤液少许于试管中,加入BaCl2(或其它含Ba2+溶液)溶液,若无明显现象(或“无白色沉淀”),说明已洗涤干净;
(5)甲酸铜能溶于水,洗涤时要减少甲酸铜的损失,所以用无水乙醇洗涤,
故答案为:减少甲酸铜晶体的损失.
点评 本题考查制备实验方案的设计,题目难度不大,注意掌握物质分离和提纯的方法和基本操作综合应用.

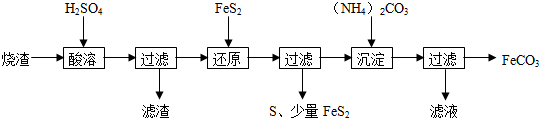
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是氢氧化铁.
(3)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++S2-=2Fe2++S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
| 弱酸 | CH3COOH | HCN | H2CO3 | NH3•H2O |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 1.8×l0-5 |
| A. | CN-+H2O+CO2=HCN+HCO3- | |
| B. | 物质的量浓度相等的溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 中和等体积、等pH的CH3HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | 0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性 |

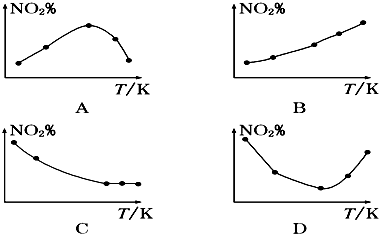
 已知:N2O4(g)?2NO2(g)△H=+52.70kJ•mol-1.
已知:N2O4(g)?2NO2(g)△H=+52.70kJ•mol-1.