题目内容
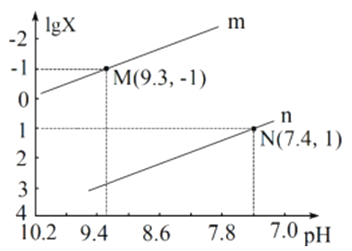
【题目】测溶液pH可研究反应过程。用盐酸分别滴定Na2CO3、 NaHCO3溶液,测得pH随加入盐酸体积的变化如下图所示(曲线②从B1点开始滴定)。下列判断不正确的是
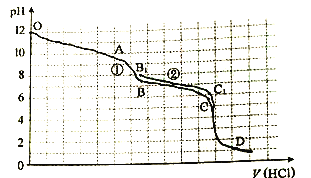
A. 曲线①表示用盐酸滴定Na2CO3的过程
B. B、C1点均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 曲线①、②说明Na2CO3与盐酸的反应分步进行
D. BC段和B1C1段发生的主要反应均是HCO3ˉ+H+=CO2↑+H2O
【答案】B
【解析】
A.Na2CO3的碱性强于NaHCO3,起始时Na2CO3的pH值较大;B.根据电荷守恒少c(Cl-);C.Na2CO3与盐酸的反应,存在两个化学计量点,分步反应;D.BC段与B1C1段为发生CO32-第二步滴定的反应过程,HCO3-转化为H2CO3。
A.Na2CO3的碱性强于NaHCO3,开始时Na2CO3的pH值较大,由图象,则曲线①表示用盐酸滴定Na2CO3的过程,故A正确;B、溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故B错误;C.Na2CO3与盐酸的反应,存在两个化学计量点,分步反应,第一步:CO32-+H+═HCO3-,第二步,HCO3-+H+═H2CO3,故C正确;D.BC段与B1C1段为发生CO32-第二步滴定的反应过程,HCO3-转化为H2CO3,则发生的主要反应均是HCO3-+H+=CO2↑+H2O,故D正确。故选B。

练习册系列答案
相关题目