题目内容
【题目】C1化学是目前研究的热点问题。
(1)己知:2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 H-H、O=O、H-O键的键能分别为436kJ/mol、496kJ/mol、462kJ/mol。则a=_______。
(2)以甲醇为原料制备H2的一种原理如下:
I.CH3OH(g) ![]() CO(g)+2H2(g) △H =+90kJ·mol-1
CO(g)+2H2(g) △H =+90kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
①在绝热恒容密闭容器中,加入一定量的CH3OH(g)在一定条件下发生反应I,下列情况能说明该反应达到平衡状态的是____________(填代号)
A.容器内温度不变
B.容器内气体总质量不再变化
C.CH3OH(g)和CO(g)的浓度之比不再变化
D.混合气体的密度不再变化
②温度为T℃时,向10L恒容密闭容器中充入1molCH3OH(g)和lmolH2O(g),发生反应I和反应II,达到平衡时测得CO的物质的量为0.4mol,CO2的物质的量为0.2mol。则反应II的平衡常数K=_____。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,则该时刻上述反应II的平衡移动方向为__________(填“正反应方向”、“逆反应方向”或“不移动”)。
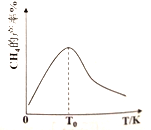
(3)H2和CO在一定条件(温度、压强和催化剂)下合成CH4,发生反应:CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
(4)合成气(H2、CO)不仅是化工原料,也是清洁能源。如果H2和CO以体积比1:1组成混合气体与空气构成碱性燃料电池(KOH溶液为电解质溶液且足量),假设CO和H2同时按比例发生反应,则燃料电池负极的电极反应式为____________________________________________。
【答案】 一220 AC 0.875或7/8 正反应方向 T0之前反应未达到平衡,升高温度,反应速率加快,CH4的产率增大 CO+H2+6OH--4e-=CO32-+4H2O
【解析】(1)①C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 ,②2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1,根据盖斯定律得①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(+130kJ·mol-1)×2-(akJ·mol-1),△H=反应物总键能-生成物总键能,则4×462kJ·mol-1-496 kJ·mol-1-462kJ·mol-1=480kJ·mol-1=(+130kJ·mol-1)×2-(akJ·mol-1),解得:a=-220 kJ·mol-1;(2)①A、绝热恒容密闭容器中,容器内温度不变,说明已达到平衡,故A正确;B、反应物和生成物全是气体,容器内气体总质量始终不变化,故B错误;C、CH3OH(g)和CO(g)的浓度之比不再变化,说明已达到平衡,故C正确;D、混合气体的总质量不变,容器的容积不变,混合气体的密度始终不变,故混合气体的密度不再改变,不能说明到达平衡,故D错误;故选AC。
② I. CH3OH(g) ![]() CO(g)+2H2(g)
CO(g)+2H2(g)
n始/mol 1
n变/mol 0.6 0.6 1.2
n平/mol 0.4 0.6 1.2
II. CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
n始/mol 0.6 1 0 1.2
n变/mol 0.2 0.2 0.2 0.2
n平/mol 0.4 0.8 0.2 1.4
温度为T℃时,向10L恒容密闭容器,将平衡时各物质的量,换成浓度,代入平衡常数计算式,反应II的平衡常数K=![]() 。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,Qc=
。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,Qc=![]() <K,则该时刻上述反应II的平衡移动方向为正反应方向。(3)CO(g)+3H2(g)
<K,则该时刻上述反应II的平衡移动方向为正反应方向。(3)CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。温度低于T0时,随着温度升高,CH4的产率增大,其原因是:T0之前反应未达到平衡,升高温度,反应速率加快,CH4的产率增大;(4)在碱性条件下,CO和H2失电子,被氧化,则燃料电池负极的电极反应式为:CO+H2+6OH--4e-=CO32-+4H2O。
H4(g)+H2O(g)△H<0。温度低于T0时,随着温度升高,CH4的产率增大,其原因是:T0之前反应未达到平衡,升高温度,反应速率加快,CH4的产率增大;(4)在碱性条件下,CO和H2失电子,被氧化,则燃料电池负极的电极反应式为:CO+H2+6OH--4e-=CO32-+4H2O。