题目内容
【题目】氯气是非常重要的化工产品,我国年产量在![]() t左右。氯气的实验室制备有多种不同方法。完成下列填空:
t左右。氯气的实验室制备有多种不同方法。完成下列填空:
(1)漂粉精固体和盐酸混合即可反应产生氯气,相关的化学反应方程式为:_____________________________________________________。发生装置选择下图中A而不是B的理由是:______________________________
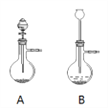
(2)实验室用此法制取纯净的氯气,可将混合气体通过盛有饱和食盐水的装置,目的是___________;为了将氯气干燥,可选用的干燥剂是___________。实验室用向上排空气法收集了一试管氯气,设计一个简单实验,验证所收集的氯气中是否收集满_________________________________________________。
(3)实验室用2.00mol/L盐酸和足量的漂粉精,若产生2.24L(标准状况)氯气,反应转移电子的物质的量是____________________,发生反应的盐酸________mL。
(4)为了比较氯、溴、碘单质的氧化性,将一定量氯气缓缓通入溴化钠溶液中时,可以看到无色溶液逐渐变为__________色;通入碘化钾溶液并加入少量苯振荡并静置后,可发现的现象______________________。
【答案】 Ca(ClO)2 + 4HCl → CaCl2 + 2Cl2↑+ 2H2O A装置便于控制反应的进程、可防止氯气等从漏斗口逸出,氯气逸出既污染空气又影响气体收集 除去氯气中的HCl 浓硫酸 将试管倒立在足量的氢氧化钠溶液中,观察试管中有无残留气体 0.1mol 100 黄 溶液分为两层,上层(苯层)为紫红色;下层几乎无色
【解析】试题分析:(1)漂粉精中的Ca(ClO)2与盐酸发生归中反应生成氯气、氯化钙、水;A装置氯气不能从漏斗口逸出,B装置氯气能从漏斗口逸出;(2)饱和食盐水能吸收氯化氢并能减小氯气的溶解度;氯气是酸性气体,可以用浓硫酸干燥;氯气能完全溶于氢氧化钠溶液;(3)根据电子转移的方向和数目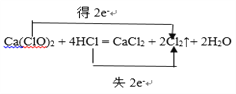 可知生成2mol氯气转移2mol电子、消耗4mol氯化氢;(4)氯气能把溴化钠中的溴置换出来;氯气能把碘化钾中的碘置换出来。
可知生成2mol氯气转移2mol电子、消耗4mol氯化氢;(4)氯气能把溴化钠中的溴置换出来;氯气能把碘化钾中的碘置换出来。
解析:(1)漂粉精中的Ca(ClO)2与盐酸发生归中反应生成氯气、氯化钙、水,反应方程式是Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2↑+ 2H2O;A装置氯气不能从漏斗口逸出,B装置氯气能从漏斗口逸出,氯气逸出既污染空气又影响气体收集,所以发生装置选择A而不选B;(2)饱和食盐水能吸收氯化氢并能减小氯气的溶解度,将混合气体通过盛有饱和食盐水的目的是除去氯气中的HCl;氯气是酸性气体,可以用浓硫酸干燥;氯气能完全溶于氢氧化钠溶液,将试管倒立在足量的氢氧化钠溶液中,观察试管中有无残留气体,若没有气体残留说明氯气已满;(3)根据 可知生成2mol氯气转移2mol电子、消耗4mol氯化氢,若产生2.24L(标准状况)氯气(0.1molCl2),反应转移电子的物质的量是0.1mol,发生反应的盐酸是0.2mol,体积是
可知生成2mol氯气转移2mol电子、消耗4mol氯化氢,若产生2.24L(标准状况)氯气(0.1molCl2),反应转移电子的物质的量是0.1mol,发生反应的盐酸是0.2mol,体积是![]() ;(4)氯气能把溴化钠中的溴置换出来,反应方程式是
;(4)氯气能把溴化钠中的溴置换出来,反应方程式是![]() ,所以可以看到无色溶液逐渐变为黄色;氯气能把碘化钾中的碘置换出来,反应方程式是
,所以可以看到无色溶液逐渐变为黄色;氯气能把碘化钾中的碘置换出来,反应方程式是![]() ,加入少量苯振荡并静置后,可发现的现象是溶液分为两层,上层(苯层)为紫红色;下层几乎无色。
,加入少量苯振荡并静置后,可发现的现象是溶液分为两层,上层(苯层)为紫红色;下层几乎无色。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案