题目内容
【题目】已知反应:![]()
![]() 。将一定量的
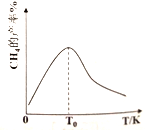
。将一定量的![]() 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

A. b点的操作是压缩注射器
B. c点与a点相比, ![]() 增大,
增大, ![]() 减小
减小
C. 平均摩尔质量: ![]()
D. d点: ![]()
【答案】A
【解析】b时气体的透光率迅速下降,说明b点的操作是压缩注射器,使体积迅速减小,NO2的浓度迅速增大,所以气体颜色加深,透光率减小,选项A正确。因为b点的操作是压缩注射器,随着体积的减小,注射器内气体的浓度一定增大,所以c点与a点相比, ![]() 增大,
增大, ![]() 增大,选项B错误。压缩体积增大压强,平衡正向移动,气体的总质量不变,总物质的量减小,所以平均分子量增大,即平均摩尔质量:
增大,选项B错误。压缩体积增大压强,平衡正向移动,气体的总质量不变,总物质的量减小,所以平均分子量增大,即平均摩尔质量: ![]() ,选项C错误。明显d点不是平衡态(透光率还在随着时间改变),所以
,选项C错误。明显d点不是平衡态(透光率还在随着时间改变),所以![]() ,选项D错误。
,选项D错误。

练习册系列答案
相关题目