题目内容
9.根据表中有关短周期元素性质的数据,判断下列说法中正确的是( )| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③的熔点低于⑥的熔点 | |
| B. | 元素①与元素⑥形成的化合物皆为碱性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:⑤>⑦>④ | |
| D. | 元素④形成的氯化物中所有原子周围都达到8电子稳定结构 |
分析 短周期元素中,①只有最低价-2,处于ⅥA族,则①为O;③⑥都最高正价+1,处于ⅠA,⑥的原子半径较大,③原子半径不是所以元素中最小,故③为Li、⑥为Na;⑤有+7、-1价,则⑤为Cl;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;②有最高价+2,处于ⅡA族,原子半径大于Li,则②为Mg;⑧有最高价+3,处于ⅢA族,原子半径小于Cl,则⑧为B,据此解答.
解答 解:短周期元素中,①只有最低价-2,处于ⅥA族,则①为O;③⑥都最高正价+1,处于ⅠA,⑥的原子半径较大,③原子半径不是所以元素中最小,故③为Li、⑥为Na;⑤有+7、-1价,则⑤为Cl;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;②有最高价+2,处于ⅡA族,原子半径大于Li,则②为Mg;⑧有最高价+3,处于ⅢA族,原子半径小于Cl,则⑧为B.
A.③为Li、⑥为Na,钠离子半径大于锂离子半径,故Li中金属键更强,故Li的熔点高于Na,故A错误;
B.元素①⑥形成的化合物为Na2O、Na2O2,前者属于碱性氧化物,或者属于过氧化物,故B错误;
C.⑤、⑦、④最高价氧化物对应水化物分别为高氯酸、硝酸、磷酸,性高氯酸是最强无机含氧酸,硝酸属于强酸,而磷酸属于中强酸,故C正确;
D.元素④形成的氯化物有PCl3、PCl5,PCl3中所有原子周围都达到8电子稳定结构,PCl5中P原子周围有10个电子,故D错误,
故选:C.
点评 本题考查元素周期表与元素周期律的综合应用,根据化合价与原子半径推断元素是解答的关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
4.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.01mol/(L•min) |
14.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w gR2-所含有电子的物质的量是( )
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w?m-n?}{n}$mol | C. | $\frac{w}{m}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
1.设nA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为nA | |
| B. | 1 mol Na2O2固体中含阴离子总数为2nA | |
| C. | 5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 nA | |
| D. | 100 mL 12mol•L-1 浓盐酸与足量MnO2加热反应,转移电子数为1.2nA |
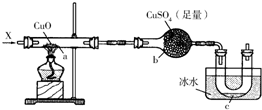 按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,(假设每个反应均完全)
按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,(假设每个反应均完全)