题目内容
4.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.01mol/(L•min) |
分析 该反应中n(NH3)=$\frac{1.7g}{17g/mol}$=0.1mol,该时间段内v(NH3)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L•min),同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,据此计算其它物质反应速率.
解答 解:该反应中n(NH3)=$\frac{1.7g}{17g/mol}$=0.1mol,该时间段内v(NH3)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L•min),同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,则v(H2)=$\frac{3}{2}$v(NH3)=0.015mol/(L•min)、v(N2)=$\frac{1}{2}$v(NH3)=0.005mol/(L•min),所以只有D选项正确,故选D.
点评 本题考查化学反应速率快慢比较,侧重考查学生分析计算能力,明确化学反应速率与计量数的关系是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.1mol某烃完全燃烧可得到2molCO2;在一定条件下,1mol该烃能与1molH2发生加成反应,这种烃是( )
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | CH3CH2CHO |
9.根据表中有关短周期元素性质的数据,判断下列说法中正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③的熔点低于⑥的熔点 | |
| B. | 元素①与元素⑥形成的化合物皆为碱性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:⑤>⑦>④ | |
| D. | 元素④形成的氯化物中所有原子周围都达到8电子稳定结构 |
16.X、Y、Z是三种主族元素,如果Xn+阳离子与Yn-阴离子具有相同的电子层结构,Zn-阴离子半径大于Yn-阴离子半径,则三种元素的原子序数由大到小的顺序是( )
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
13.下列说法正确的是( )
| A. | 容量瓶、分液漏斗、滴定管在使用前都需要检查是否漏水,可以用相同的实验方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的$\frac{1}{2}$ | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 将灼烧后的海带灰加水煮沸2-3分钟的目的是加快碘化物在水中的溶解,使灰烬中的碘离子尽可能多的进入溶液 |
14.欲将AlCl3溶液中的铝离子沉淀完全,最合适的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | AgNO3溶液 | D. | NaCl溶液 |
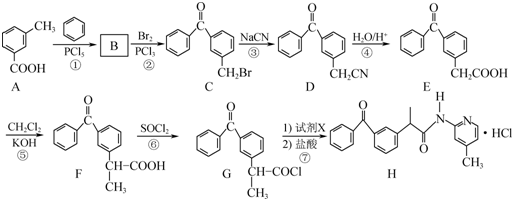
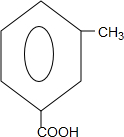 +
+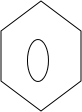 $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$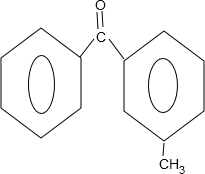 +H2O.
+H2O.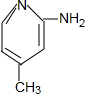 .
.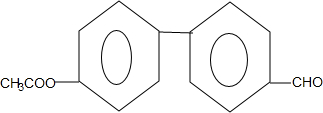 (只写一种).
(只写一种).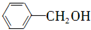 和
和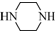 为原料制备
为原料制备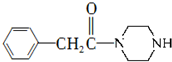 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).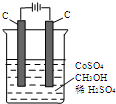 电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:
电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则: