题目内容
【题目】某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH溶液的该衍生物的结构式有( )
A.1种B.2种C.3种D.4种
【答案】B
【解析】
分子式为C8H10O,不饱和度为4,又为某苯的衍生物,而苯环本身的不饱和度就为4,这说明考虑取代基时不用考虑不饱和键。又因为有两个对位的取代基,计算一下除了苯环外还含有多少个碳氢氧,用C8H10O减去-C6H4(因为有两个取代基),还有-C2H6O,即有两个碳,六个氢和一个氧。该物质不溶解于NaOH溶液,说明不含有酚羟基(即没有-OH直接连接在苯环上的结构)。只能把-C2H6O分为一个-OCH3和-CH3或一个-CH2OH和-CH3这两种结构。
由分析,有两种结构,对甲基苯基甲醚(即苯环互为对位的地方分别连一个-OCH3和-CH3)、对甲基苯甲醇两种(即苯环互为对位的地方分别连一个-CH2OH和-CH3)。如图: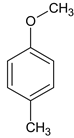 、
、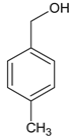 ,故选B。
,故选B。

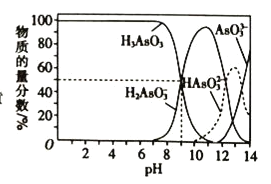
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
已知:[Fe(NO)]2+在溶液中呈棕色。
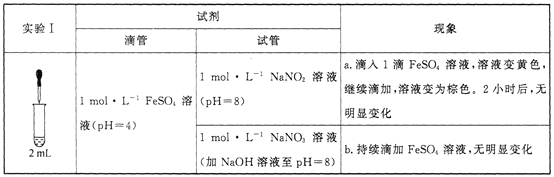
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
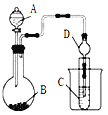
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。
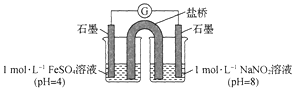
(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
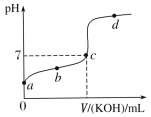
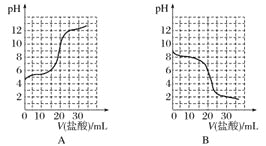
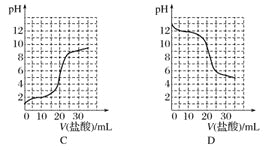
【题目】下列实验操作能达到实验目的的是( )
选项 | 操作 | 目的 |
A | 用酚酞作指示剂,用标准的c mol·L-1盐酸滴定一定体积未知浓度的 | 测定 |
B | 将一定量 | 配制一定物质的量浓度的 |
C | 给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中 | 证明气体产物含碳碳双键 |
D | 在 | 证明 |
A.AB.BC.CD.D