题目内容
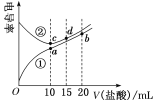
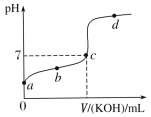
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5 mol·L-1。该温度下,向20mL0.01 mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。
请回答下列有关问题:
(1)a、b、c、d四点中水的电离程度最大的是___点。
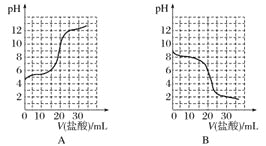
(2)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是___填序号)。
(3)把FeCl3溶液加热蒸干,灼烧,得固体物质为___(填化学式)。
【答案】c B Fe2O3
【解析】
(1)酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大;
(2)由于稀氨水显碱性,且为弱碱不完全电离,从而分析解答;
(3)把FeCl3溶液加热蒸干,HCl有挥发性,水解得到Fe(OH)3,灼烧得Fe2O3。
(1)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大;
(2)由于稀氨水显碱性,首先排除选项A和C;两者恰好反应时溶液显酸性,排除选项D,故正确的答案为B;
(3) 把FeCl3溶液加热蒸干,促进FeCl3的水解,HCl有挥发性,水解得到Fe(OH)3,灼烧得Fe2O3。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】根据表中信息,判断下列叙述中正确的是
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | Cl﹣ | ||
② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
③ | KClO3 | 浓盐酸 | Cl2 |
A.表中①组反应可能有一种或两种元素被氧化
B.表中②组反应的离子方程式是2 MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O
C.表中③组反应的还原产物是KCl,电子转移数目是6e﹣
D.氧化性强弱比较:KClO3>Fe3+>Cl2>Br2