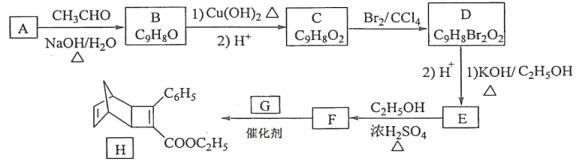
题目内容
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。

已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。

(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
【答案】KSCN 两个实验过程均有O2但NaNO3溶液中无明显变化 ![]() +e-+H2O === NO↑+2OH- 证实Fe2+被
+e-+H2O === NO↑+2OH- 证实Fe2+被![]() 氧化生成Fe3+ 将NO通入FeSO4溶液中溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化 Fe2++
氧化生成Fe3+ 将NO通入FeSO4溶液中溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化 Fe2++![]() +2H+=== Fe3++NO↑+H2O Fe2++NO === [Fe(NO)]2+
+2H+=== Fe3++NO↑+H2O Fe2++NO === [Fe(NO)]2+
【解析】
(1)①可用![]() 检验铁离子;
检验铁离子;
②对比实验中滴加溶液都会携带氧气;
③![]() 在正极上得电子被还原生成
在正极上得电子被还原生成![]() ,可证明
,可证明![]() 与亚铁离子发生氧化还原反应;
与亚铁离子发生氧化还原反应;
(2)要证明![]() 与
与![]() 发生了反应,可将
发生了反应,可将![]() 分别通入
分别通入![]() 溶液中,根据颜色变化判断;
溶液中,根据颜色变化判断;
(3)酸性条件下,![]() 溶液、
溶液、![]() 溶液发生氧化还原反应生成
溶液发生氧化还原反应生成![]() ,亚铁离子与
,亚铁离子与![]() 反应生成
反应生成![]() 。
。
(1)①KSCN与铁离子反应,溶液显血红色,则可用![]() 检验铁离子,
检验铁离子,
故答案为:![]() ;
;
②对比实验中滴加溶液都会携带氧气,但![]() 溶液中无明显变化,则
溶液中无明显变化,则![]() 不是主要原因,
不是主要原因,
故答案为:两个实验过程均有![]() ,但
,但![]() 溶液中无明显变化;
溶液中无明显变化;
③![]() 在正极上得电子被还原生成
在正极上得电子被还原生成![]() ,电极方程式为
,电极方程式为![]() ,实验Ⅱ的目的是证实
,实验Ⅱ的目的是证实![]() 被
被![]() 氧化生成
氧化生成![]() ,
,
故答案为:![]() ;证实
;证实![]() 被
被![]() 氧化生成
氧化生成![]() ;
;
(2)想证明![]() 与
与![]() 发生了反应,可将
发生了反应,可将![]() 分别通入
分别通入![]() 溶液中,可观察到将
溶液中,可观察到将![]() 通入
通入![]() 溶液中,溶液由浅绿色变黄色最后变棕色,将
溶液中,溶液由浅绿色变黄色最后变棕色,将![]() 通入
通入![]() 溶液中,无明显变化,
溶液中,无明显变化,
故答案为:将![]() 通入
通入![]() 溶液中,溶液由浅绿色变黄色最后变棕色,将
溶液中,溶液由浅绿色变黄色最后变棕色,将![]() 通入
通入![]() 溶液中,无明显变化;
溶液中,无明显变化;
(3)酸性条件下,![]() 溶液、
溶液、![]() 溶液发生氧化还原反应生成
溶液发生氧化还原反应生成![]() ,亚铁离子与
,亚铁离子与![]() 反应生成
反应生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,同时发生
,同时发生![]() ,
,
故答案为:![]() ;
;![]() 。
。

 阅读快车系列答案
阅读快车系列答案