题目内容
【题目】25℃,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示,下列说法错误的是( )
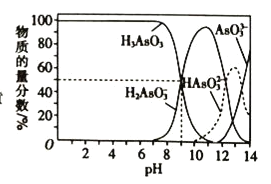
A.H3AsO3为三元弱酸,其一级电离平衡常数Ka1=10-9
B.NaH2AsO3在溶液中水解程度大于电离程度
C.pH=9的溶液中c(H+)>c(H3AsO3)= c(H2AsO3-)
D.a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-)
【答案】C
【解析】
根据题中各种微粒的物质的量分数随pH的变化曲线可知,本题考查盐类水解中粒子大小的比较,运用水解是微弱的原理分析。
A. pH=9时,溶液中存在H3AsO3![]() H2AsO3-+H+,此时
H2AsO3-+H+,此时![]() =
=![]() mol/L,
mol/L,![]() =
= ![]() ,则
,则 ![]() ,A项正确;
,A项正确;
B. 由图可知NaH2AsO3溶液显碱性,以水解为主,由此可知NaH2AsO3在溶液中水解程度大于电离程度,B项正确;
C. 由图可知pH=9的溶液中,c(H3AsO3)= c(H2AsO3-),此时溶液显碱性,则c(OH-)>c(H+),但不确定c(H+)>c(H3AsO3)= c(H2AsO3-),C项错误;
D. a点时,由图可知溶液中H2AsO3-物质的量分数最高,而H3AsO3和HAsO32-的物质的量分数相等且远小于H2AsO3-,因此a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-),D项正确;
答案选C。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目