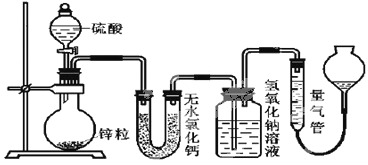
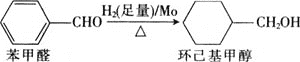
题目内容
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
【答案】B
【解析】
A.金属钠着火不可用泡沫灭火器灭火,钠燃烧产生过氧化钠,会与二氧化碳反应生成氧气,这样会使火燃烧得更旺,故A错误;
B.常温下,Fe、Al遇浓硫酸或浓硝酸在金属的表面生成一层致密的氧化物而发生钝化,所以常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化,故B正确;
C.蔗糖是非还原性糖,没有醛基,不能发生银镜反应,故C错误;
D.电解精炼铜时,由于阳极有铁、锌等杂质存在,若阳极质量减少32g,则转移电子的物质的量无法计算,故D错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】实验室制备1,2-溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2
CH2=CH2+H2O CH2=CH2+Br2![]() BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
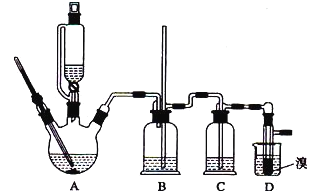
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点(℃) | 78.5 | 132 | 34.6 |
熔点(℃) | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是______。
(3)在装置c中应加入____(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是_______。
(5)将1, 2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”)。
(6)若产物中有少量未反应的Br2,最好用______(填正确选项前的字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用________的方法除去。
(8)反应过程中应用冷水冷却装置D,其主要目的是_________;但又不过度冷却(如用冰水),其原因是______________________。