题目内容
9.短周期元素X、Y、Z、W的原子序数一次增大,X与Z、Y与W分别处于同一主族.X可分别与其他三种元素形成化合物.Z为同周期内原子半径最大的元素(稀有气体元素除外).Z、Y形成的某化合物跟Z、W形成的某化合物的摩尔质量相等.下列说法正确的是( )| A. | 四种元素的最高正化合价都等于其所在的族序数 | |
| B. | X与Y、X与W分别形成的简单阴离子对水的电离的影响相似 | |
| C. | Z2W溶液呈碱性的原因可表示为W2-+2H2O?H2W+2OH- | |
| D. | X与Y、Y与Z均可形成具有强氧化性的化合物 |
分析 Z为同周期内原子半径最大的元素(稀有气体元素除外),则Z处于ⅠA族,由于X、Y、Z、W是原子序数依次增大的短周期元素,且Y与W处于同一主族,则Z只能为Na元素;X可分别与其他三种元素形成化合物,则X为H元素;Z、W应该分别处于第二、第三周期的同一主族元素;Z、Y形成的某化合物跟Z、W形成的某化合物的摩尔质量相等,则Y为O、W为S,形成的化合物分别为过氧化钠、硫化钠,据此进行解答.
解答 解:Z为同周期内原子半径最大的元素(稀有气体元素除外),则Z处于ⅠA族,由于X、Y、Z、W是原子序数依次增大的短周期元素,且Y与W处于同一主族,则Z只能为Na元素;X可分别与其他三种元素形成化合物,则X为H元素;Z、W应该分别处于第二、第三周期的同一主族元素;Z、Y形成的某化合物跟Z、W形成的某化合物的摩尔质量相等,则Y为O、W为S,形成的化合物分别为过氧化钠、硫化钠,
A.O元素没有最高正价,故A错误;
B.X与Y、X与W分别形成的简单阴离子分别为OH-、HS-,氢氧根离子抑制了水的电离,硫氢根离子促进了水的电离,二者对水的电离的影响不同,故B错误;
C.Z2W为Na2S,硫离子的水解分步进行,主要以第一步为主,正确的离子方程式为:S2-+H2O?HS-+2OH-,故C错误;
D.X与Y可形成化合物双氧水,Y与Z可形成过氧化钠,双氧水和过氧化钠都具有强氧化性,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
19.下列有关离子方程式书写正确的( )
| A. | 向含1molFeI2溶液中通入标准状况下22.4LCl22Fe2++2I-+2Cl2=2Fe3++I2+2Cl- | |
| B. | 在Na2S溶液中滴加少量FeCl3 2Fe3++S2-═2Fe2++S↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO${\;}_{3}^{-}$ |
20.下列操作能达到实验目的是( )
| A. | 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 | |
| B. | 在纯锌与稀硫酸的反应混合物中滴入少量Cu(NO3)2溶液后生成H2的反应速率加快 | |
| C. | 各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上称量 | |
| D. | 用如图所示装置吸收氨气可防倒吸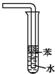 |