题目内容
19.在下列操作中,所使用的仪器能够达到目的是( )| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |
分析 A.量筒精确到0.1;
B.托盘天平的准确度为0.1g;
C.过滤时,用玻璃棒引流,但不能用玻璃棒搅拌漏斗内液体;
D.萃取剂的选择与密度无关.
解答 解:A.量筒精确到0.1,故A错误;
B.由于托盘天平只能准确到0.1g,不用托盘天平称取6.82g食盐,故B错误;
C.过滤时,用玻璃棒引流,但不能用玻璃棒搅拌漏斗内液体,否则易损坏滤纸,故C错误;
D.萃取剂的密度不一定比水大,只要符合萃取剂与原溶剂互不相溶,溶质在萃取剂中的溶解度比在水中大,且萃取剂与水的密度有差别即可,故D正确.
故选D.
点评 本题考查了计量仪器及其使用方法,要求学生熟练掌握常见计量仪器构造及使用方法,本题难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
6.碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如图,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2.
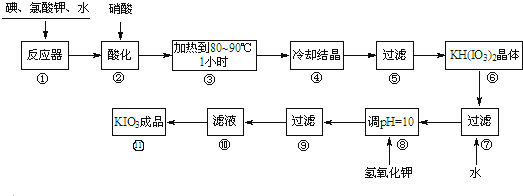
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为60e-;
(2)步骤②中,用硝酸而不用HI,其原因可能是HI具有还原性,能将已生成的碘酸氢钾还原;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2及Cl2与KOH反应生成的KClO,能将KIO3氧化成KIO4;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有漏斗、烧杯、玻璃;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:KOH+KH(IO3)2=2KIO3+H2O;
(6)参照下表碘酸钾的溶解度,步骤 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.

试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为60e-;
(2)步骤②中,用硝酸而不用HI,其原因可能是HI具有还原性,能将已生成的碘酸氢钾还原;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2及Cl2与KOH反应生成的KClO,能将KIO3氧化成KIO4;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有漏斗、烧杯、玻璃;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:KOH+KH(IO3)2=2KIO3+H2O;
(6)参照下表碘酸钾的溶解度,步骤
 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
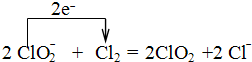 .
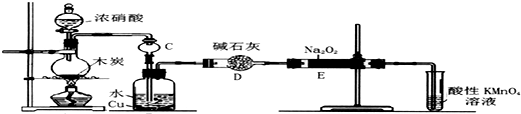
.

 或
或 ;
;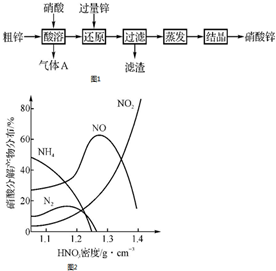 硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.
硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.