题目内容
5.硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示).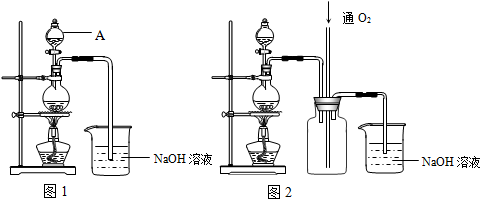
(1)图1烧瓶中发生的离子反应方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
(2)图2是图1的改进装置,其优点有:①可防止倒吸;②NO、NO2有毒气体能被完全吸收.
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤.蒸发.结晶,滤渣作催化剂循环使用.(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7.6.4.)
请回答下列问题:
①方案1中的B仪器名称是坩埚.
②方案2中甲物质是b(填字母序号).
a.CaO b.CuCO3 c.CaCO3 d.NH3?H2O
以加入FeSO4为例,用离子方程式解释反应发生的原因4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++Cu═2Fe2++Cu2+.
方案3:将3.2g铜丝放到45mL 1.5mol/L的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1小时后,过滤.蒸发结晶.减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.6g.
③上述三种方案中,更符合绿色化学理念的是方案3(填方案1、方案2、方案3),理由是方案1要灼烧,消耗能源多.方案2得到的产品中含有铁元素杂质.方案3几乎不产生有害气体,且得到的产品纯度高.
分析 (1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,随着反应的进行,浓硝酸变成稀硝酸,稀硝酸和铜反应生成硝酸铜和一氧化氮、水.
(2)根据一氧化氮的性质及尾气处理装置分析;
(3)①方案1中,将铜在坩埚中灼烧生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜;
②方案2中,铜与硫酸铁反应生成硫酸铜、硫酸亚铁,通入氧气,将亚铁离子氧化成硫酸铁,然后为保证不引入杂质,可加入氧化铜、碳酸铜等调节pH值除去铁离子,过滤、蒸发、结晶得到硫酸铜晶体;
③根据绿色化学理念:耗能少,无污染,原料利用率高,产品纯度高等判断.
解答 解:(1)将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,铜粉与稀硫酸不反应,铜与浓硝酸反应,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,随着反应的进行,浓硝酸变成稀硝酸,稀硝酸和铜反应生成硝酸铜和一氧化氮、水,3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)改进前,二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮有毒且和水不反应,所以NO、NO2有毒气体不能被完全吸收,且二氧化氮和氢氧化钠反应后,导管内压强减小,易产生倒吸现象;改进后,通入氧气,氧气、一氧化氮、二氧化氮、水反应完全生成硝酸被氢氧化钠吸收;且中间储气瓶有缓冲作用,防止倒吸.
故答案为:可防止倒吸;NO、NO2有毒气体能被完全吸收;
(3)①加热固体应在坩埚中进行,
故答案为:坩埚;
②铜与硫酸铁反应生成硫酸铜、硫酸亚铁,通入氧气,将亚铁离子氧化成硫酸铁,为保证不引入杂质,可以加入氧化铜、碳酸铜等调节pH值可除去铁离子,过滤、蒸发、结晶得到硫酸铜晶体,涉及的反应的离子方程式为 4Fe2++O2+4 H+═4Fe3++2H2O、2Fe3++Cu═2Fe2++Cu2+,
故答案为:b;4Fe2++O2+4 H+═4Fe3++2H2O、2Fe3++Cu═2Fe2++Cu2+;
③上述三种方案中,方案1要灼烧,消耗能源多,方案2得到的产品中含有铁元素杂质,方案3几乎不产生有害气体,且得到的产品纯度高,故方案3更符合绿色化学理念,
故答案为:方案3;方案1要灼烧,消耗能源多,方案2得到的产品中含有铁元素杂质,方案3几乎不产生有害气体,且得到的产品纯度高.
点评 本题考查化学实验,意在考查对化学实验原理、实验设计和实验结论的运用能力.实验是高考中的重点内容,题型以选择题和填空题为主,考查的内容常以典型的实验基本操作及正误判断等为主.

| A. | Na+ Ba2+ Cl- SO42- | B. | K+ Na+ NO3- OH- | ||
| C. | H+ NH4+ Fe3+ SO42- | D. | H+ Cl- CO32- NO3- |
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯 | |
| B. | 分子式为C4H8Cl2结构中含一个-CH3的同分异构体(不考虑立体异构)有5种 | |
| C. | 1mol乙酰水杨酸( )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 可用 和HCHO为原料合成 和HCHO为原料合成 |
| A. | NaCl易溶于水 | B. | 熔融的NaCl能导电 | ||
| C. | NaCl不易分解 | D. | NaCl溶于水呈中性 |
 ;
; ;
;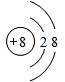 .
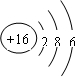
. H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题: ;
;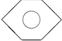 )、④甲苯(
)、④甲苯(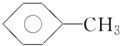 ),
), .此反应属于取代反应.
.此反应属于取代反应.