题目内容
2.下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )| A. | Na+ Ba2+ Cl- SO42- | B. | K+ Na+ NO3- OH- | ||
| C. | H+ NH4+ Fe3+ SO42- | D. | H+ Cl- CO32- NO3- |
分析 A.钡离子与硫酸根离子反应生成硫酸钡沉淀;
B.四种离子之间不反应,加入氢氧化钠溶液后也不反应;
C.氢离子、铵根离子、铁离子与加入的氢氧化钠溶液反应;
D.氢离子与碳酸根离子反应.
解答 解:A.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故A错误;
B.K+ Na+ NO3- OH-之间不反应,加入氢氧化钠溶液后也不发生反应,在溶液中能够大量共存,故B正确;
C.Fe3+与氢氧化钠溶液反应生成氢氧化铁沉淀,不符合条件,故C错误;
D.H+、CO32之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:“且加入氢氧化钠溶液后也不产生沉淀”.

练习册系列答案
相关题目
13.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | VA=1.0 mol/(L•S) | B. | VB=0.6 mol/( L•S) | C. | VC=1.6 mol/(L•S) | D. | VD=2.0 mol/(L•S) |
10.CH3COOH分别跟H-18O-C2H5和H-16O-C2H5起酯化反应后,两者生成水的质量( )
| A. | 前者大 | B. | 前者小 | C. | 相等 | D. | 不能确定 |
17.对下列反应类型判断正确的是( )
| A. | CH3COOH+C2H5OH→CH3COOCH2CH3+H2O 取代反应 | |
| B. | CH2=CH2+O2→CH3COOH 加成反应 | |
| C. | CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O 酯化反应 | |
| D. | C6H6+HNO3→C6H5-NO2+H2O 氧化反应 |
7.下列说法正确的是( )
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
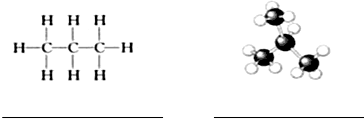
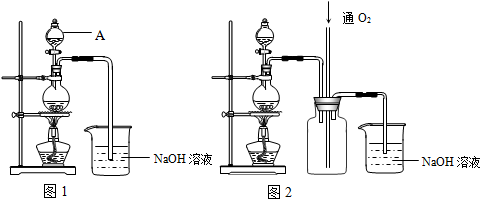
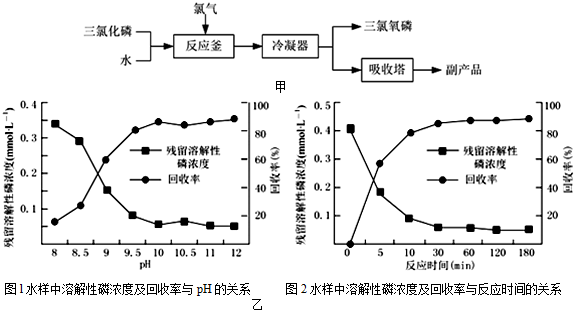
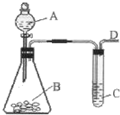 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.