题目内容
【题目】Cu—Mn—Al合金为磁性形状记忆合金材料之一,可用来制作各种新型的换能器、驱动器、敏感元件和微电子机械操纵系统。
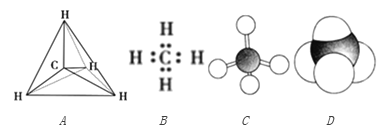
(1)下列状态的铝中,最外层电离出一个电子所需能量最小的是______(填标号)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)AlCl3是某些有机反应的催化剂,如苯与乙酰氯反应的部分历程为:

①乙酰氯分子中碳原子的杂化类型为____。
②乙酰氯分子中∠CCCl___120°(填“>”、“=”或“<”),判断理由是_______。
③![]() 的空间构型为________。
的空间构型为________。
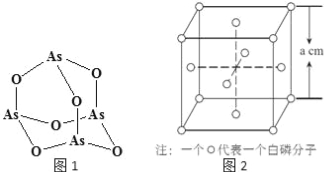
(3)温度不高时气态氯化铝为二聚分子(其结构如图所示)。

写出Al2Cl6的结构式并标出配位键______。
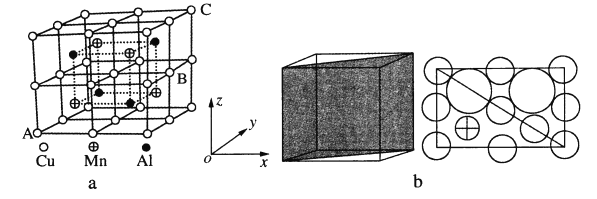
(4)Cu—Mn—合金的晶胞如图a所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0,0),C为(1,1,1),则B原子的坐标参数为_____。
②由晶胞可知该合金的化学式为_____。
③已知r(Cu)≈r(Mn)=127pm,r(Al)=143pm,则Cu原子之间的最短核间距离为____pm。
④该晶胞的密度为_____g·cm-3。(列出计算式即可,阿伏加德罗常数用NA表示)
【答案】B sp3sp2 < 双键对单键的排斥力大于单键对单键的排斥力 正四面体 ![]() (1,
(1,![]() ,
,![]() ) AlMnCu2 180
) AlMnCu2 180![]() 或
或![]() 或311.76
或311.76 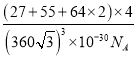
【解析】
(1)铝的第三电离能>第二电离能>第一电离能,基态大于激发态,ACD属于基态、B属于激发态,所以电离最外层一个电子所需能量最小的是B;
(2)①根据乙酰氯分子的结构可知该物质中甲基上的C原子形成4个σ键,价层电子对数为4,为sp3杂化;另一个C原子形成3个σ键,1个π键,所以价层电子对数为3,为sp2杂化;
②双键对单键的排斥力大于单键对单键的排斥力,所以乙酰氯分子中∠CCCl小于120°;
③![]() 中心铝原子的价层电子对数为
中心铝原子的价层电子对数为![]() =4,不含孤电子对,所以为正四面体形;
=4,不含孤电子对,所以为正四面体形;
(3)根据氯化铝二聚分子的结构可知每个氯原子与4个氯原子形成4个σ键,由于铝原子最外层有只有3个电子,所以其中一个为配位键,由铝提供空轨道,氯原子提供孤电子对,所以Al2Cl6的结构式为![]() ;
;
(4)①A为原点,C为(1,1,1),B为右面面心,所以B的坐标为(1,![]() ,
,![]() );
);
②根据均摊法,该晶胞中Cu原子的个数为![]() =8,Mn原子的个数为4,Al原子的个数为4,所以该合金的化学式为AlMnCu2;
=8,Mn原子的个数为4,Al原子的个数为4,所以该合金的化学式为AlMnCu2;
③根据截面图结合几何知识可知[2r(Cu)+2r(Al)]为体对角线的一半,设晶胞的棱长为a,则有![]() a=2[2r(Cu)+2r(Al)]=4×(127+143)pm,所以a=
a=2[2r(Cu)+2r(Al)]=4×(127+143)pm,所以a=![]() pm;根据晶胞结构可知铜原子之间的最短核间距为棱长的一半,即
pm;根据晶胞结构可知铜原子之间的最短核间距为棱长的一半,即![]() a=180
a=180![]() pm或
pm或![]() pm或311.76pm;
pm或311.76pm;
④晶胞的质量m=![]() g,晶胞的体积V=a3=(
g,晶胞的体积V=a3=(![]() )3pm3=(
)3pm3=(![]() ×10-10)3cm3,所以晶胞的密度
×10-10)3cm3,所以晶胞的密度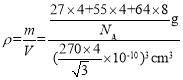 =
=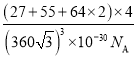 g·cm-3。
g·cm-3。

 名师指导期末冲刺卷系列答案
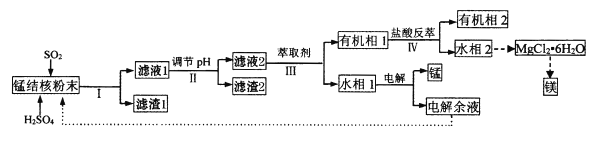
名师指导期末冲刺卷系列答案【题目】用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
已知:①几种难溶物的溶度积(25℃)如下表所示:
化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______,“滤渣2”的成分为______。
(3)“Ⅲ”处“萃取剂”萃取的成分是___;“Ⅳ”处用“盐酸反萃”的作用是____。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____。
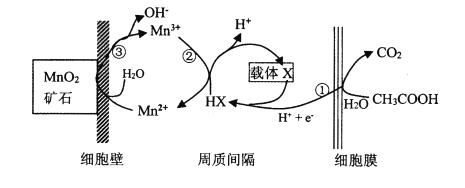
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________。